1. 서 론
지구에서 가장 큰 일시적인 탄소 저장고인 해양은 산업혁명 이후 지금까지 인류가 대기로 방출한 CO2의 약 25%를 흡수하여(Le Quéré et al., 2018) CO2 증가에 따른 지구 온난화를 완화시키는데 기여해왔다. 대기의 CO2가 해수에 용해되는 일련의 화학반응은 하나의 식으로 요약된다.
| $${\mathrm{CO}}_2+{\mathrm H}_2\mathrm O+{\mathrm{CO}}_3^{2-}\Leftrightarrow2\mathrm{HCO}_3^-$$ | (1) |
여기서 해양의 CO2 흡수는 표층 해양에서 염기성인 탄산이온(CO32-)의 소모를 동반한다. 이 반응의 결과로 해수는 산성화된다.
해양 산성화는 해양 생태계에 다양한 충격을 가할 수 있는 잠재력을 지녔는데 그 가운데 과학적으로 신뢰도가 높게 알려진 것이 석회화 생물에 악영향을 줄 것이라는 예상이다(Gattuso et al., 2011). 해양에 서식하는 여러 석회질 분비 동식물 분류군이 탄산칼슘 광물로 이루어진 껍데기를 만들어 세포 보호와 부력 조절(Armstrong et al., 2002)을 비롯한 다양한 기능을 수행하고 있다. 탄산칼슘 광물화, 즉 석회화 반응은 아래의 화학식으로 표현된다:
| $$\mathrm{Ca}^{2+}+{\mathrm{CO}}_3^{2-}\rightarrow\;{\mathrm{CaCO}}_3$$ | (2-1) |
탄산이온의 제거는 탄산염계 화학종의 재분배를 일으키는데 일반 해수의 pH 범위에서 우점하는 화학종인 중탄산이온이 탄산이온을 보충하게 되며 이 과정에서 이산화탄소가 발생한다:
| $$2\mathrm{HCO}_3^-\rightarrow{\mathrm{CO}}_3^{2-}+{\mathrm{CO}}_2+{\mathrm H}_2\mathrm O$$ | (2-2) |
위 두 반응을 요약한 화학식으로 나타내면 다음과 같다.
| $$\mathrm{Ca}^{2+}+2\mathrm{HCO}_3^-\rightarrow{\mathrm{CaCO}}_3+{\mathrm{CO}}_2+{\mathrm H}_2\mathrm O$$ | (2-3) |
대기에 증가한 이산화탄소가 해양에 흡수되면(해양 산성화) 중탄산이온의 농도가 증가하므로(식 (1)) 석회화가 촉진될 수 있다는 그릇된 인상을 주기 쉽다. 하지만 실제로 현장에서의 석회화 반응은 탄산이온의 농도에 의해 조절되며(식 (2-1)) 따라서 탄산칼슘의포화상태에 의해 좌우된다. 석회화 과정은 용존무기탄소(DIC)와 총알칼리도(TA)를 1 : 2의 비율로 소모하면서 대기에서 해수에 더해진 CO2와 풍화로 공급된 용존무기탄소와 알칼리도의 증가를 완화시켜 해수의 화학적 항상성을 유지시키는 중요한 역할을 하고 있다.
해양 산성화에 따른 석회화 생물의 피해 정도를 가늠하는데 중요한 지표는 탄산칼슘 광물의 생성과 용해를 결정하는 포화상태(saturation state)로서 통상 Ω로 표기하며 다음 식으로 계산한다:
| $$\Omega=\frac{\lbrack\mathrm{Ca}^{2+}\rbrack\times\lbrack{\mathrm{CO}}_3^{2-}\rbrack}{\mathrm K_{\;\;\mathrm{sp}}^{\;\;\ast}}$$ | (3) |
식에서 [ ]는 칼슘이온과 탄산이온의 화학량 농도(μmol kg-1)이고 K*sp는 현장 수온과 염분에서 탄산염 광물의 화학량론적인 겉보기 용해도곱이다. K*sp는 포화상태일 때 칼슘이온 농도와 탄산이온 농도의 곱에 해당한다.
해수의 Ω의 값이 1 이상일 때 광물에 대해 과포화이며 1보다 작으면 불포화 상태로 탄산칼슘에 대해 부식성을 띠어 광물의 용해가 일어난다. 해양에서 대표적인 생물기원 탄산칼슘 광물로는 방해석(calcite)와 선석(aragonite) 두 가지 광물이 있는데, 둘의 화학조성은 CaCO3로 같으나 결정구조가 다르다. 방해석은 선석에 비해 열역학적으로 안정한 구조여서 방해석의 포화 탄산이온 농도가 선석보다 낮다. 그 결과로 해양에서 선석의 용해는 방해석보다 얕은 수심에서 일어난다.
해양의 표층에서 Ω는 석회화 생물에게 유리한 과포화 상태인데 반해 심해에서는 불포화 상태로 바뀌면서 탄산칼슘광물이 용해된다. 수심에 따른 Ω 감소의 주원인은 심층에서 유기물 분해에 따라 발생한 대사성 CO2에 의한 산성화이다(Gruber and Sarmiento, 2002). K*sp는 압력 상승과 수온 감소에 따라 증가하는데 대체로 이들은 수심의 증가에 동반된다.
연구 지역인 동해는 심층수를 자체적으로 형성하고 있고, 해수의 체류시간이 천년 규모인 대양에 비해 1/10 가량인 100년 규모로 훨씬 짧은 것으로 알려져 있는 데다(Watanabe et al., 1991; Tsunogai et al., 1993), 대륙주변해여서 생물 생산성이 높기 때문에(Kwak et al., 2013) 인류 기원 CO2가 침투하기에 양호한 조건을 갖추고 있다. 따라서 Ω의 변화와 이와 관련된 영향을 연구하기에 적지이다. 동해는 중위도권의 대륙주변해이지만 빠르고 고립된 순환 특성(Yoon et al., 2018)에 비추어 탄산칼슘 포화상태가 극지해에 못지않게 빠르게 감소될 가능성이 있다.
본 연구에서는 인류 기원 CO2가 동해의 울릉분지로 침투하는 것에 대한 반응을 보고자 과거에 발표된 탄산칼슘 포화면(saturation horizon) 수심과 최근 상태를 비교하는데 목적을 두었다. 관련 연구로 가장 이르게는 1992년도의 동해의 방해석과 선석의 포화면 수심이 각각 1,300 m와 300 m라 발표된 바 있으며(Chen et al., Chen), Kim et al.(2010)은 인류 기원 CO2 흡수로 인해 1800년 ~ 1999년 사이에 500 ~ 600 m로 추정되었던 선석 포화면 수심이 약 50 ~ 250 m 상승하였다고 보고하였다. 하지만 심층수가 만들어지는 일본분지 위주로 연구가 진행되어 왔고 최근에 들어 이산화탄소 관측 연구가 더 활발한 울릉분지를 주목한 연구는 없었다. 울릉분지는 동해 심층수 순환의 하류역으로 심층수의 용승이 일어나는 곳이며 표층은 남쪽에서 난류가 진입하는 아열대성 생태구로서 탄산염 광물 관점에서 복잡하고 흥미로운 해역이다.
이 논문에서는 최근의 현장 조사로 획득한 탄산염계의 매개변수인 pHT, 총알칼리도(TA)와 총용존무기탄소(DIC) 자료를 사용하여 울릉분지의 탄산칼슘 포화상태를 계산하고 이전에 발표된 동해의 값과 비교하고 최근의 변화 동향이 지니는 의미에 대해 고찰하였다.
2. 자료와 방법
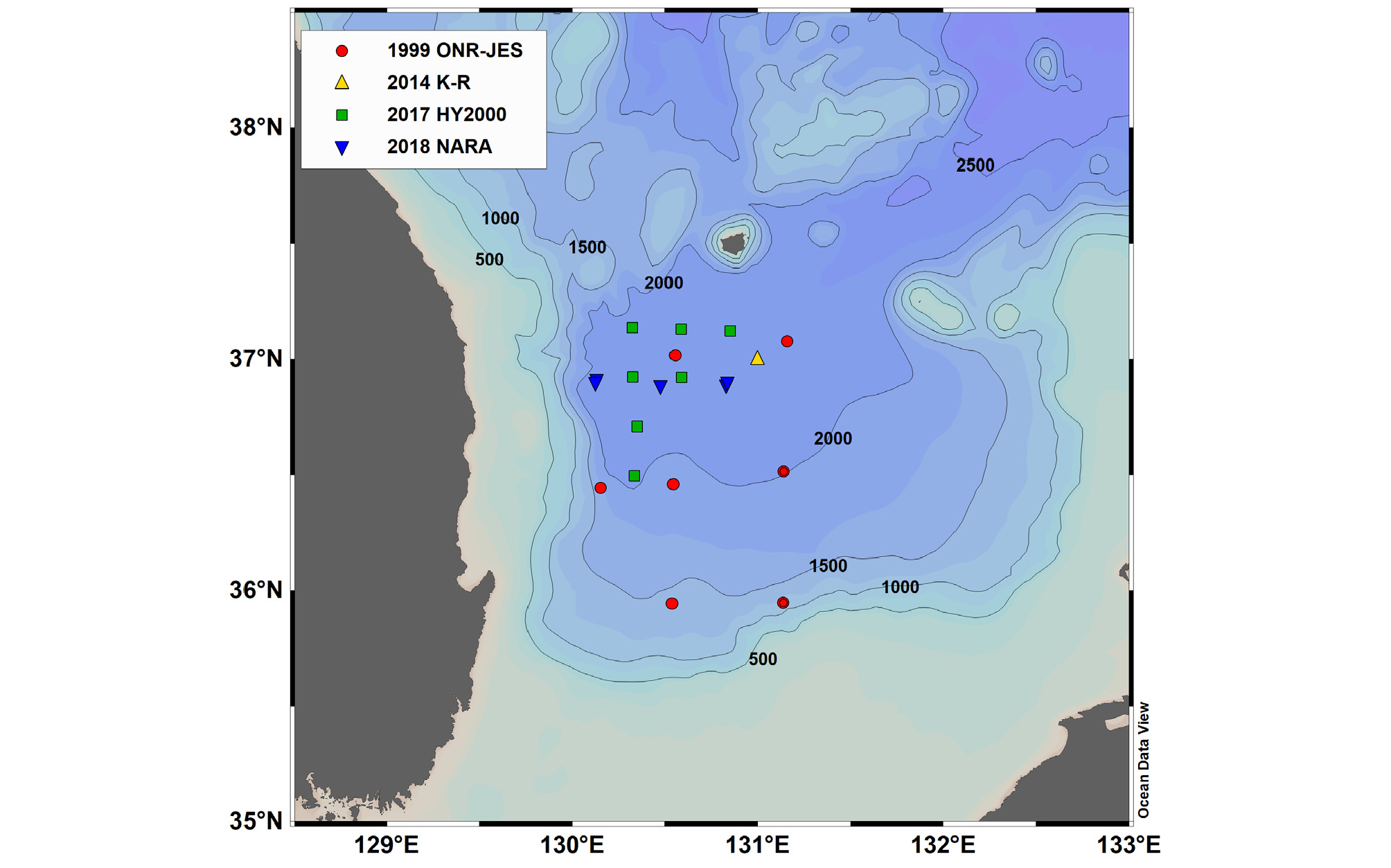
탄산칼슘 포화상태 계산에는 울릉분지에 대한 1999년 7월 ONR-JES 프로그램 현장 조사 자료와 2014년 4월 한국-러시아 공동조사 자료 그리고 2017년 5월 해양 2000과 2018년 3월 나라호 조사 자료를 사용하였다(Fig. 1). 자료는 모두 CTD-rosette 시스템에 의해 측정된 수온과 염분 그리고 수심별 채수 시료에서 분석한 탄산염 매개변수들을 사용하였다. 시간 경과에 따른 변화를 찾되 해저 지형의 영향을 배제시키고자 수심이 2,000 m 이상인 정점들의 자료들만 사용하였다.
직접 측정하지 않은 탄산염계 매개변수들은 CO2SYS (Lewis and Wallace, 1998)에 DIC와 TA 자료를 입력하여 계산하였다. 기준년도인 1999년도의 경우는 예외로 TA와 pHT가 입력 자료로 쓰였다. CO2SYS를 이용해서 계산한 변수들은 방해석과 선석의 탄산염 포화상태(각각 Ωc와 Ωa)와[CO32-]이다. 탄산의 해리상수 K1, K2의 값으로는 가장 널리 쓰이는 Dickson and Millero(1987)가 수정한 Mehrbach et al.(1973)의 값을 사용하였다.
DIC와 TA 분석 시료는 선상에서 니스킨 채수병에서 500 ml 붕규산 병에 해수를 내려받아 약 5 ml의 상부 공간을 남기고 생물 활동에 의한 변질을 방지하기 위하여 200 μl의 과포화된 염화수은(HgCl2)을 첨가한 후 밀봉하여 실험실로 운반하여 분석하였다. 시료의 DIC와 TA는 VINDTA 3C로 측정하였다. 시료는 25°C에서 해양 이산화탄소 분석 지침서(Dickson et al., 2007)에 따라 분석하였다.
TA는 염산을 사용하여 전위차 적정법(potentiometric titration)으로 측정하였다. DIC는 시료를 인산으로 산성화시켜 해수에 녹아있던 용존무기탄소를 이산화탄소 기체 변환시켜 방출된 총량을 전류량계(coulometer)로 측정하였다.
TA와 DIC 측정의 정도 관리는 Dickson (SIO)의 인증표준물질(CRM)을 병행 분석하여 수행하였다. 반복 측정을 통한 CRMs 분석 오차는 약 1.5 μmol kg-1이고, 시료의 반복 측정 분석 오차는 약 2 μmol kg-1였다. 따라서 총 분석오차 수준은 2.5 μmol kg-1 이하이다.
3. 결과와 토의
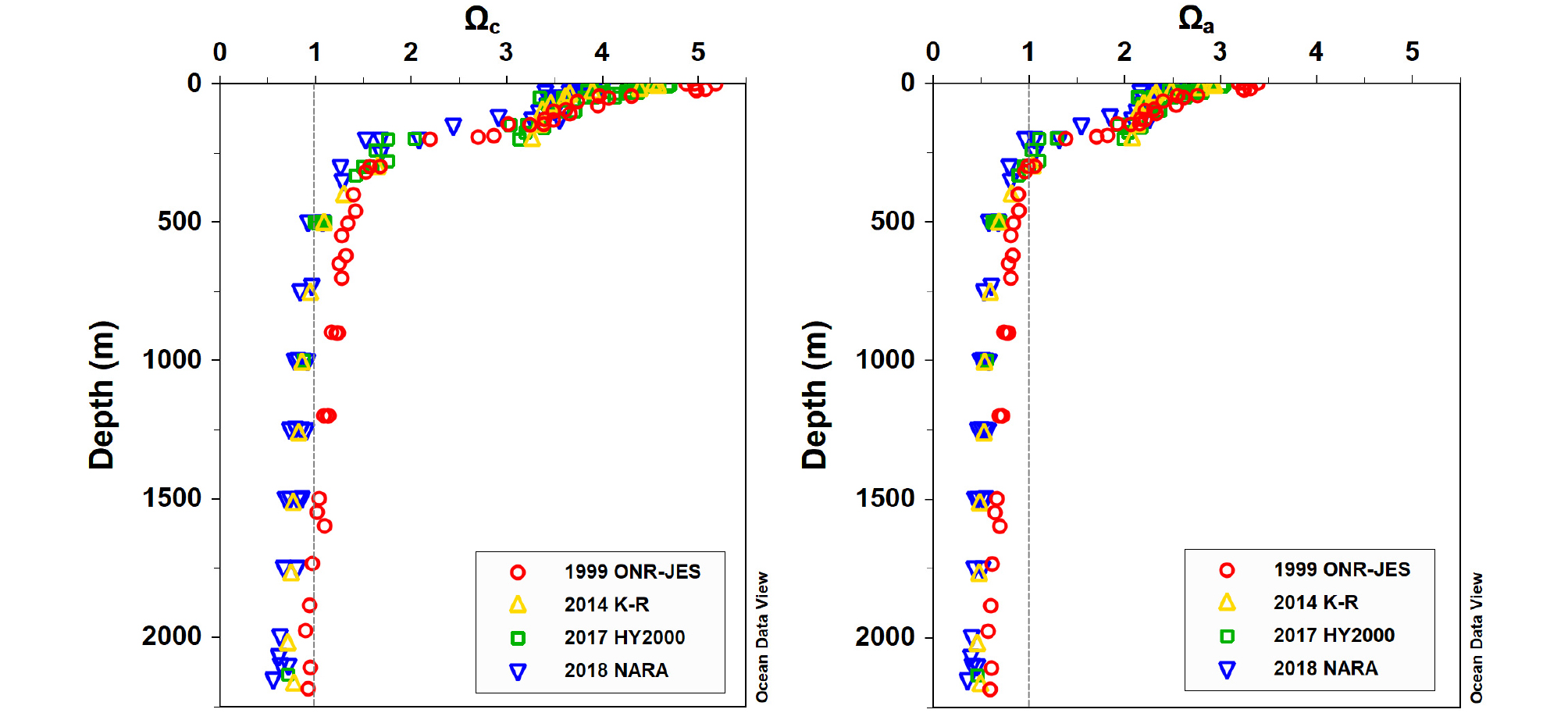
1999년에 비해 2010년대에 울릉분지 표층에서 방해석과 선석의 포화상태(Ωc와 Ωa)가 모두 약 0.5 정도 낮아졌으며 Ω = 1인 포화면 수심 또한 얕아졌다(Fig. 2). 1999년 여름철에 울릉분지에서 Ωc = 1이 되는 방해석 포화면(CSH: calcite saturation horizon) 수심은 약 1,400 m이었으며, 선석 포화면(ASH: aragonite saturation horizon) 수심은 약 300 m이었다. 2010년대에 들어 CSH는 크게 상승하여 약 600 ± 100 m이며, ASH는 조금 얕아진 약 250 ± 50 m였다(Table 1). 포화면 수심의 오차는 DIC와 TA 분석 오차, 2.5 μmol kg-1를 수심으로 환산한 수층의 두께이다.
Table 1. Reported depth (m) of the saturation horizon for calcite and aragonite in the East Sea including the Ulleung Basin
| year | calcite | aragonite | site1 | data2 | source |
| 1960s ~ 1990s | - | 300 - 600a | ES | DIC, TA | Kim et al. (2010) |
| 1992 | 400 - 600 | ES | DIC, TA | Kim et al. (2010) | |
| 1300 | 300 | ES | DIC, TA | Chen et al. (1995) | |
| 1999 | 1000 | 400 | ES | TA, pHSWS | Park et al. (2006) |
| 900 - 1100 | 100 - 500 | ES | TA, pHb | Tishchenko et al. (2012) | |
| 1400 | 300 | UB | TA, pHT | this study | |
| 2007 | 300 - 500 | ES | DIC, TA | Kim et al. (2010) | |
| 2010s | 500 - 700 | 200 - 300 | UB | DIC, TA | this study |
2 DIC: dissolved inorganic carbon; TA: total alkalinity
a predicted using temperature, pressure, and O2 concentration
b scale of pH is not specified
CSH가 불과 20년 만에 800 m나 얕아진 것은 겉보기에 엄청난 상승 속도로 보인다. 하지만 울릉분지 500 m 수심보다 깊은 심층수가 거의 같은 수온과 염분을 보이는 균질한 해수여서 Ωc가 수심에 따라 완만하게 감소하는 특성과 분석 오차가 끼어들어 과대평가된 결과일수도 있다. 1999년도와 2010년대의 포화면 수심 계산에 사용된 두 탄산염계의 짝이 다른 점과 해리상수의 선택 등에서 비롯된 차이 그리고 실험 오차를 감안하면 실제 CHS의 상승은 훨씬 작을 수 있어서 잠정적인 해석에 그치므로 주의가 필요하다(아래 토의 참조).
이전 발표 자료와 비교하면 포화면 수심이 얕아지고 있는 추세는 확실하다(Fig. 3, Table 1). CSH와 ASH는 매년 각기 약 28 m와 약 6 m씩 얕아지고 있다. 이런 추세가 이어진다면 ASH는 2060년 무렵에 표층에 도달하게 된다. IPCC의 IS92a 고-CO2 배출 시나리오 아래에서 ASH의 산업화 이전 시기의 전 지구 평균이 1,090 m에서 2100년(대기 CO2 = 788 ppmv)에 280 m로 얕아질 전망이다(Orr, 2011). 이로 보아 울릉분지에서 탄산칼슘 포화면 수심 상승은 전 지구 평균을 크게 웃돈다.
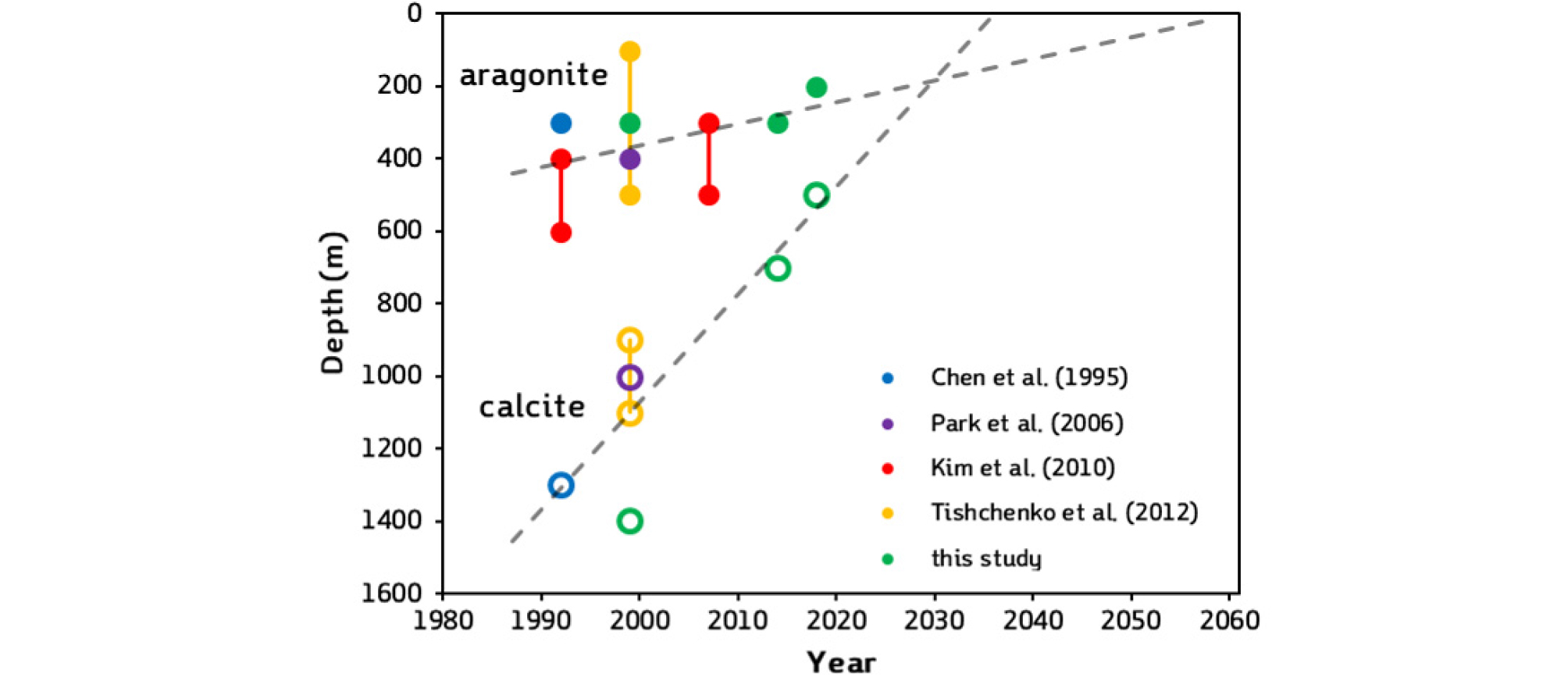
Fig. 3.
Depth variation of ASH (closed circles) and CSH (open circles) by time in Chen et al., 1995 (blue), Park et al., 2006 (purple), Kim et al., 2010 (red), Tishchenko et al., 2012 (yellow), and this study (green). CSH: calcite saturation horizon, ASH: aragonite saturation horizon.
Park et al.(2006) 또한 본 연구와 같이 1999년 ONR-JES 자료를 사용하였으나, CSH와 ASH 수심은 각각 1,000 m와 400 m로 산출해 본 연구의 1,400 m와 300 m와 상당한 차이를 보였다. Park et al.(2006)은 식 (3)을 사용하여 포화상태를 계산하였는데 pHT를 pHSWS로 변환하여 사용했다. 칼슘이온 농도는 일정성분비의 원리를 이용하여 염분에서 구하였고, [CO32-]는 TA와 pHSWS로 계산한 DIC와 TA을 이용하여 계산하였다. K*sp의 값은 공통적으로 Mussi(1983)를 사용하였으나 압력에 대한 보정을 Millero(1995)에 따라 수행한 반면에 본 연구에서 사용한 CO2SYS 프로그램은 방해석의 경우에는 Ingle(1975)을, 선석의 경우에는 Millero(1979)을 따르고 있다. Orr et al.(2018)에 따르면 같은 자료를 쓰더라도 계산 결과는 선택한 상수들과 용해도곱에 따라 차이가 날 수 있다. 이러한 차이는 앞으로 동해 탄산염계의 연구에서 메타데이터 작성이 필수적임을 지적하고 있다.
역시 1999년 ONR-JES 자료를 사용한 Tishchenko et al.(2012)은 CSH의 경우 900 ~ 1,600 m, ASH 수심은 100 ~ 600 m이라 보고하였다. 저자들 또한 pH와 TA로 계산하였으나, pH의 단위는 언급하지 않았으며 현장 온도에 대한 보정 여부를 언급하지 않았다. 그리고 모든 측정 자료를 사용해서 연안 자료가 포함되어서 수심의 범위가 넓게 제시되었다.
2010년대 자료만 살펴보아도 포화면 수심이 지속적으로 얕아지고 있는 경향을 확인할 수 있다(Fig. 2). 2014년에 비해 2018년에 CSH은 약 700 m에서 400 m로 약 300 m 얕아졌으며, ASH는 100 m 가량 얕아져서 200 m 부근이 되었다. 심층의 탄산칼슘 포화상태 역시 2010년대에 낮아졌으며, Ωc는 0.9에서 0.5로 약 0.4, Ωa는 0.6에서 0.4로 약 0.2 정도 낮아졌다. 포화면 수심이 얕아진 것은 표층부터 심층까지 전반적으로 포화상태가 감소하여 발생한 결과로 보인다. 이는 대기 CO2가 증가함에 따라 해양 표면의 pCO2가 높아지게 되고 심층수 형성과 순환에 따라 해수의 pH와 [CO32-]가 감소한 대서양에서 포화상태가 낮아지고 포화면 수심이 얕아진 것(Feely et al., 2004; Orr et al., 2005)과 닮았다. 한편 고위도에 위치한 아이슬란드해에서는 1985 - 2008년 사이에 ASH가 매년 약 4 m의 속도로 빠르게 상승하였는데(Olafsson et al., 2009) 울릉분지에서는 상승이 이보다 더 빠르게 나타났다.
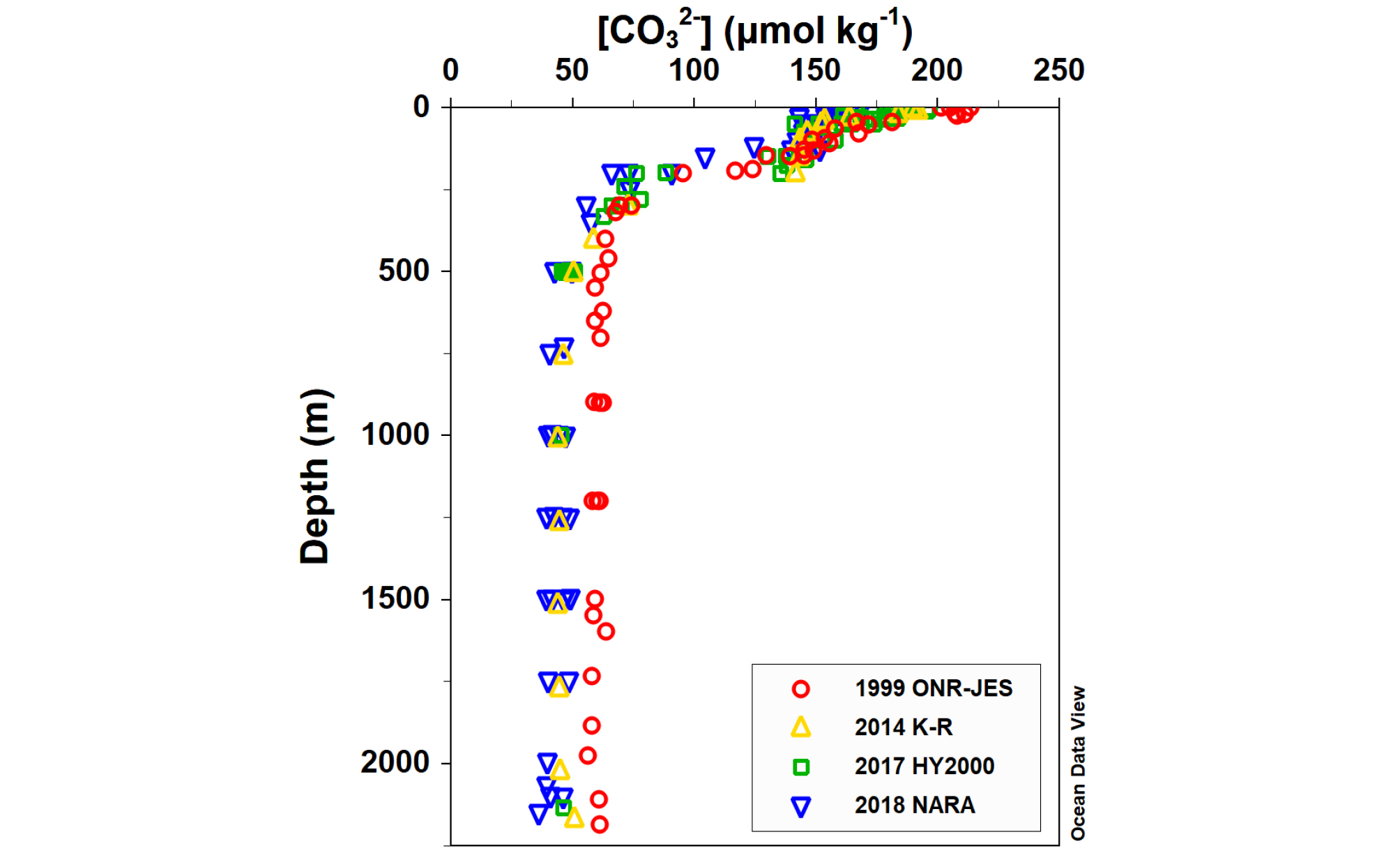
울릉분지에서 포화상태가 감소하고 포화면 수심이 얕아지고 있는 것은 인류 기원 CO2가 계속해서 침투한 결과로 해석된다. 탄산칼슘 포화상태의 변화는 식 (3)에서 [CO32-]가 주도하는데 실제로 1999년에 비해 2010년대에 전 수심에서 [CO32-]가 약 15 ~ 30 μmol kg-1 정도 감소하였으며, 감소는 표층에서 더 뚜렷했다(Fig. 4). 1999년에는 [CO32-]는 표층에서 약 208 μmol kg-1이고, 대략 200 ~ 300 m까지 농도가 급격히 감소하고 보다 깊은 수심에서는 일정해져 심층에서는 약 60 μmol kg-1였으나, 2010년대에는 표층에서 약 175 μmol kg-1이고, 심층에서는 약 44 μmol kg-1로 감소하였다. 500 m 수심 아래에서 [CO32-]는 거의 일정해지고 시간에 따른 농도의 감소 또한 작다. 표층에서 [CO32-]의 감소율은 약 1.8 μmol kg-1 yr-1 이며, 이는 대양에서 약 0.5 ~ 1 μmol kg-1 yr-1의 값을 보인 것에 비해 높다(Orr, 2011 and Table 3.1 therein). 따라서 약 500 m보다 얕은 곳, 특히 표층에서 [CO32-]가 크게 감소한 것은 대기-해양 간의 기체 교환이 활발하여 인류 기원 CO2가활발하게 흡수되고 있음을 의미한다. 1995 ~ 2009년 동안 울릉분지 표층에서 pH가 지속적으로 낮아지고 있는 것이(Kim et al., 2014) 이를 지지한다.
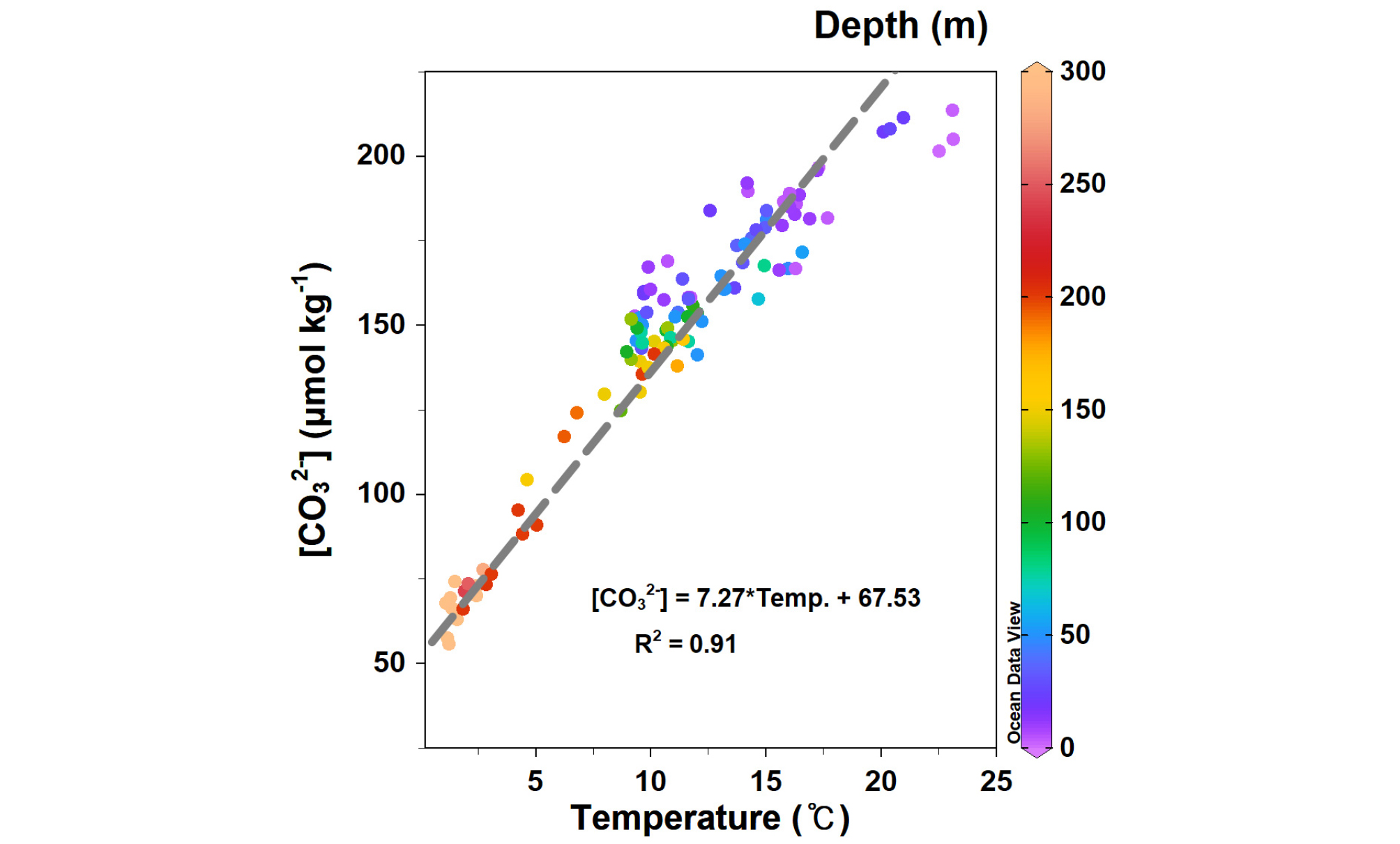
대양의 표층 [CO32-]는 남빙양의 평균 105 μmol kg-1부터 적도로 가면서 약 240 μmol kg-1까지 높아져서 강한 양의 수온 상관성을 보인다(Orr et al., 2005). 울릉분지의 경우에 [CO32-]는 수온과 표층 300 m까지 강한 상관관계(R2 = 0.91)를 보인다(Fig. 5). 표층수가 가진 특성이 300 m 수심 가까이까지 나타나는 것은 겨울철 표층 해수 혼합의 영향이 미치는 범위를 반영하고 있는 것으로 보인다.
대양의 심층에서 [CO32-]는 표층보다 낮은 80 ~ 125 μmol kg-1 농도를 보이고 대서양에서 더 높게 나타난다(Broecker and Sutherland, 2000; Goodwin and Lauderdale, 2013). 울릉분지의 심층에서는 [CO32-]가 50 μmol kg-1 부근의 좁은 범위를 보이는데(Fig. 4) 이는 대양의 최소값보다도 더 낮은 농도이다. 이는 심층수가 대기 CO2의 침투에 대해 pH 완충 능력이 매우 낮음을 알려준다.
울릉분지 심층에서 [CO32-]가 대양보다 낮은 것은 현재 동해의 심층이 북태평양과 해수 교환이 단절되어 있는 특성을 고려할 때 탄산이온의 공급이 적다는 것을 알려준다. 표층에 서식하는 석회화 플랑크톤에 의한 생물학적 펌프가 주된 탄산이온의 공급원이라 보이는데 침강입자 포획 연구에 따르면 탄산칼슘 플럭스가 우세하게 나타난 적은 없다(Kim et al., 2017). 따라서 대기 CO2의 침투와 빈약한 탄산칼슘 공급이 겹쳐져서 포화면 수심이 빠르게 얕아지게 하는 것으로 해석된다.
해수의 교체(ventilation) 방식의 변화 또한 Ω에 영향을 미칠 수 있다. 해수의 교체가 약화되면 해수 사이의 혼합이나 교환이 줄어들어 물기둥에서 유기물의 분해가 일어날 시간이 더 오래 주어지고 이에 따라 특히 성층이 강화된 물기둥에서 CO2 농도가 높아지게 될 것이라는 주장이 제기되었다(Chen et al., 2017). 해수 내 CO2의 축적은 [CO32-]를 감소시켜 Ω 값을 낮춘다. 따라서 울릉분지에서 [CO32-]와 Ω가 감소한 것은 인류 기원 CO2의 침투와 해수 교체 양상의 변화와 약화(Yoon et al., 2018)가 복합적으로 작용하여 일어난 결과일 확률이 높아 보인다.
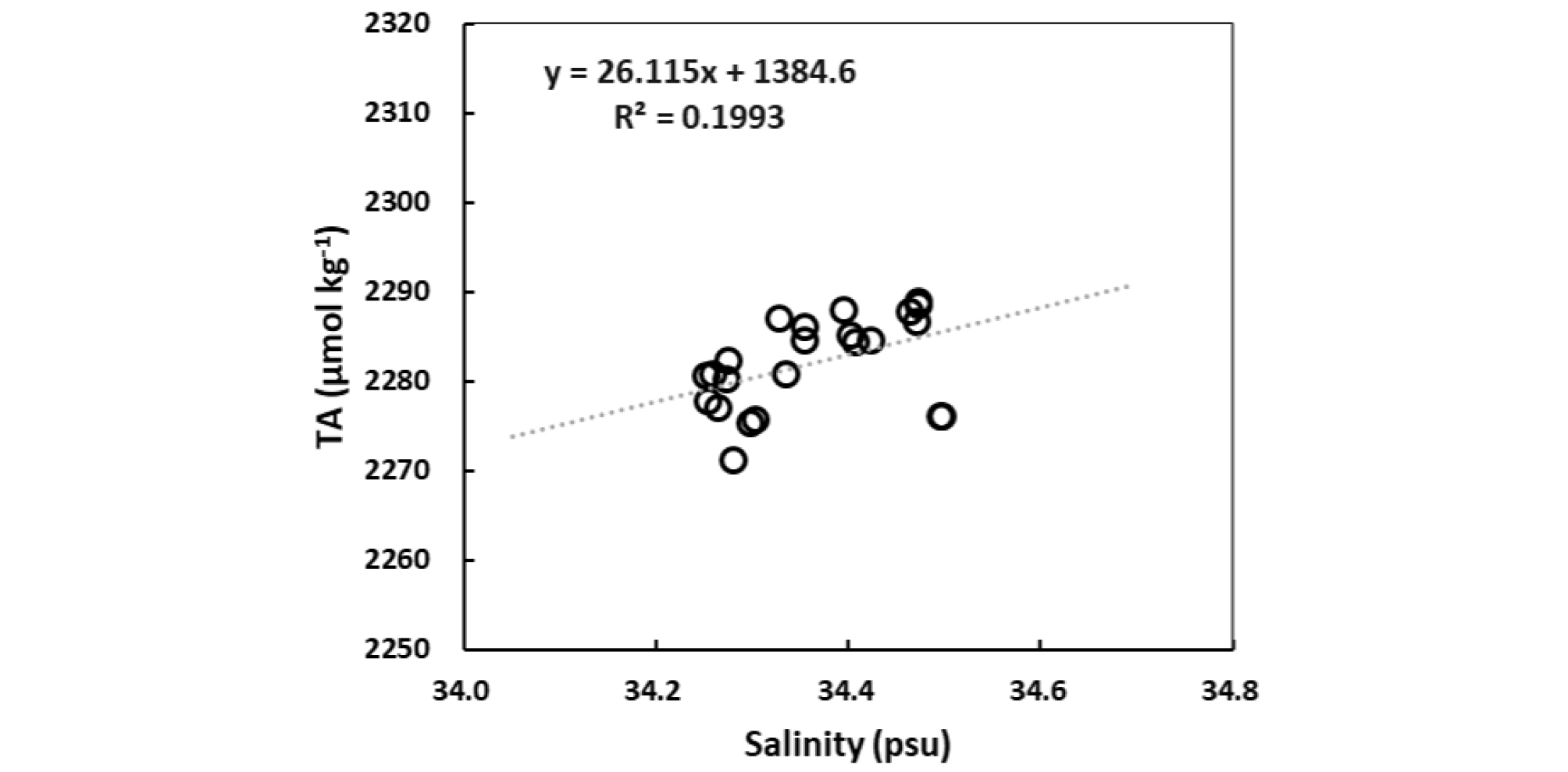
알칼리도의 연직분포 특성에 비추어 만약 심층수 형성이 온난화의 영향으로 약화되었다면 이는 심층에서 표층으로의 알칼리도 공급 또한 약해짐을 뜻한다. 그런데 울릉분지 표층수의 [CO32-]는 CO2의 침투가 지속될 수 있을 정도로 비교적 높게 유지되고 있다. 이는 심층수 이외의 알칼리도 공급원이 있음을 시사한다. 가능성이 높은 후보로는 강 유출수와 황사(Asian dust)를 들 수 있는데 황사에 의한 알칼리도 공급은 아직 평가된 바 없다. 장강을 비롯한 중국 동남부와 낙동강 등 하천 유출수의 알칼리도는 TA-염분 관계로 유추해 볼 때(Fig. 6) 약 1,400 μmol kg-1에 이르는 확실한 알칼리도 공급원이다. 울릉분지 표층은 겨울을 빼고는 중국 대륙에서 배출된 강물에 의해 저염화된 동중국해 표층수로 덮인다(Chang and Isobe, 2003). 이를 감안하면 울릉분지 표층의 비교적 높은 [CO32-]는 강물 유입에 도움을 받고 있는 것이 확실하다.
전 지구 해양의 상태에 대해 주요한 결과로서 1766년에서 2007년 사이에 탄산칼슘 포화상태가 약 20%가 감소하였으며, 2100년에 이르면 40%까지 감소될 것으로 예상된다(Gattuso and Hansson, 2011). 결과적으로 탄산칼슘 포화면 수심은 고려 대상 탄산칼슘 광물 유형에 따라 GLODAP 기준년도인 1994년에도 산업화 전보다 80 ~ 200 m 얕아졌다(Feely et al., 2004). 최근에 들어 선석의 계절적 불포화는 고위도 지역의 표면 해수에서 가장 두드러진 변화가 관찰되었다. 예측 모형에서는 수십 년 내에 선석의 불포화가 남빙양(Orr et al., 2005)과 북극해(Steinacher et al., 2009)에서 광범위하게 나타날 것이라 지목하였다. 같은 맥락에서 울릉분지의 ASH 수심이 표층까지 상승한다면 이는 보다 산성을 띤 심층수와 혼합이 이루어지는 겨울철에 시작될 확률이 높고, 울릉분지 서부의 울기-감포 여름철 용승역에서는 선석에 대해 불포화된 저층수가 표층으로 올라오므로 가장 이르게 피해를 받을 것으로 예상된다. 따라서 탄산칼슘 포화상태에 대한 동향 파악은 시계열 관측으로 수행되어야 하며 특히 현재 자료가 없는 겨울철과 용승역 자료가 시급하다.
탄산칼슘의 침전은 직관과는 다르게 무기탄소 농도가 감소하더라도 해수 중 [CO2]를 증가시킨다(식 (2)-(3)). 결과적으로 해양 표면에서 탄산칼슘을 생산해서 심해로 수송하는 것은 대기의 CO2를 증가시키는 경향이 있다. 석회화 생물(calcifiers)이 사라질 경우에 단기적으로는 대기 CO2 수준에 대한 소규모 음의 되먹임이 발생되는 역설적인 결과가 초래된다. 또한 해양 탄산염 펌프(carbonate pump)는 탄소 저장량을 변경시키는 것에 더해 해양의 DIC와 TA의 연직 분포에 변화를 일으킨다는 점도 중요하다. 이 과정은 해양 표면의 화학을 변화시키고 심층까지 변화를 일으켜 해양 전체를 변화시키는데 ~1,000년 이상의 시간 규모에서 대기 CO2를 감소시키는데 중요할 수 있다고 알려져 있지만 규모가 작고 대양에 비해 얕은 울릉분지에서는 100년 규모에서 가능하다.
탄산칼슘 광물은 입자꼴 유기 탄소(POC)를 심해로 이동시키는데 크게 기여하는데(Armstrong et al., 2002) 이는 광물질이 POC에 추가적인 무게를 추가시켜서 침강 속도를 빨라지게 하기 때문이다. 따라서 탄산칼슘 생산 감소는 POC에 대한 무게 더하기를 감소시켜 침투 깊이를 감소시키고 POC를 더 얕은 깊이에서 분해되게 할 것이다. 이로 인해 연조직 펌프(soft-tissue pump)의 전반적인 효율이 감소하여 대기 CO2에 양의 되먹임으로 작용할 것이다. 이는 석회화 감소에 따른 음의 되먹임을 상쇄할 수 있다. 이러한 흥미로운 가설은 울릉분지에서 시공간적으로 효율적으로 검정될 수 있다. 따라서 울릉분지에서 탄산염계 연구는 적절한 방법, 특히 시계열 관측을 통해 이루어져야 할 필요가 있다.
4. 요 약
울릉분지에서 탄산칼슘 포화면은 인류 기원 CO2의 침투에 따라 얕아지고 있는데 얕아지는 속도는 계산 상 오류와 불확실성을 감안하더라도 매우 빠른 편이다. 이처럼 탄산칼슘 포화면이 빠르게 상승하는 이유는 석회화 생물에 의한 탄산칼슘의 심해 공급 플럭스가 낮은데다 동해의 독자적인 심층수 형성과 심해 순환으로 침투한 CO2가 빠르게 [CO32-]를 소모한 결과로 판단된다. 울릉분지 심층수의 [CO32-]는 대양에 비해 뚜렷하게 낮으며 이것이 지닌 의미는 CO2의 침투가 지속될 경우에 해양산성화에 대한 완충 능력이 매우 미약하다는 것이다. 하지만 탄산칼슘 포화도는 온난화, 해수 순환, 생지화학의 제반 과정이 복잡하게 얽혀 관여하고 있기 때문에 이번의 단기 추세 연구로 얻은 결과가 선형으로 지속될 것이라 예단하기 어려우므로 정기적인 감시 연구가 필요하다.