1. 서 론
해양의 저서성 착생 와편모류 Ostreopsis는 열대와 아열대를 비롯하여 온대해역에 이르기까지 매우 광범위한 해역에 분포하는 것으로 보고되고 있으며, 주로 해조류를 비롯하여 바위, 모래, 무척추 동물 등에 부착하여 서식하거나, 종종 수주에 떠다니면서 유해 조류 대발생(Harmful Algal Blooms)을 유발하기도 한다(Shears and Ross, 2009; Rhodes, 2010; Sato et al., 2011; Parsons et al., 2012; Tawong et al., 2014). 우리나라에서는 제주도 주변 연안을 비롯하여 남해에 위치한 백도와 추자도, 포항 연안에서 Ostreopsis spp.의 출현이 보고된 바 있다(Kim et al., 2011; Back, 2012; Kang et al., 2013; Lee and Park, 2018).
Ostreopsis 속에는 모식종(type species)인 O. siamensis를 비롯하여 지금까지 총 11 종이 기술되어 있으며, 이 중 다수의 종이 맹독인 팰리톡신(palytoxin, PTX)을 생산하는 것으로 알려져 있다(Schmidt, 1901; Ukena et al., 2001; Tichadou et al., 2010; Parsons et al., 2012; Accoroni et al., 2016; Verma et al., 2016). 이러한 독은 해양먹이망을 통해 어류, 갑각류, 조개류 등의 상위영양단계 생물로 전달되며, 이러한 팰리톡신에 중독된 수산물을 인간이 섭취하였을 경우 신경마비 등을 유발하며 심한 경우 생명에 위협을 준다고 보고하였다(Taniyama et al., 2003; Aligizaki et al., 2008; Ramos and Vasconcelos, 2010). 또한, 기질 부착성이 낮은 Ostreopsis는 종종 수주를 떠다니므로 유해 조류 대발생을 일으키는 것으로 보고되었다. 이때, 팰리톡신이 에어로졸 형태로 대기로의 확산이 일어나는 것이 보고되었으며, 이러한 유독 에어로졸에 노출되었을 경우에 심각한 호흡곤란 증세가 발생한 것으로 보고되었다(Ciminiello et al., 2006).
한편, Ostreopsis에 속하는 종들은 광학현미경상에서 외형적인 특징이 매우 유사하고, 세포 크기에 있어서 종내 변이와 종간 변이의 범위가 서로 겹치기 때문에, 현장에서 이들 개체군의 변화를 모니터링하기 위한 종 분류와 동정에 있어서 많은 어려움이 있다(Penna et al., 2005). 뿐만 아니라, 실내 배양 종주로 확립한 경우, 종주내의 형태학적 변이가 더욱 증가하여 현미경을 이용한 이들의 종 수준의 구분이 더욱 어렵다(Sato et al., 2011). 따라서, 최근 유독 저서성 와편모류 Ostreopsis의 지리적 분포와 종다양성에 관한 연구를 위해, 이들의 형태학적인 특징과 더불어 유전자 마커, 즉 SSU rDNA, LSU rDNA (D1/D2 혹은 D8/D10영역), ITS-5.8S rDNA 영역 등을 이용하여 분석이 진행되었으며, 이 가운데 가장 명확하게 종 수준(species/clade/subclade)의 분류가 가능한 LSU rDNA D8/D10 영역을 이용하여 작성한 분자계통수가 가장 해상도가 높고, 신뢰성 있는 유전자 마커로 보고되었다(Sato et al., 2011; Tawong et al., 2014). 이러한 분자계통학적 연구를 통해서 모식종인 O. siamensis를 비롯하여 O. cf. ovata와 새로운 종으로 추정되는 Ostreopsis spp. 1-7의 총 9개의 분기군(clade)으로 나뉘어지는 것을 확인하였다. 이 중에서 서로 근연관계를 형성하나 통계적으로 뚜렷하게 다른 분기군으로 나뉘어지는 O. cf. ovata, Ostreopsis sp. 1과 Ostreopsis sp. 2는 O. ovata 종복합체(O. ovata species-complex)로 보고하였다(Sato et al., 2011; Tawong et al., 2014). 우리나라와 지리적으로 가까이 위치한 일본 연안에서는 O. cf. ovata를 비롯하여 Ostreopsis sp. 1-5에 해당하는 총 6가지 타입의 다양한 유전형을 가진 Ostreopsis가 광범위하게 분포하여 다른 해역과 비교하여 매우 높은 다양성을 가지는 것으로 보고되었다.
따라서, 본 연구에서는 춘계에 우리나라 제주연안에서 유독 착생 와편모류 Ostreopsis의 출현양상을 조사하고 이들의 형태적인 특징 및 LSU rDNA D8/D10 영역을 이용한 분자계통학적 분석을 통해 어떠한 유전자 타입이 출현하고 있는지에 대해 규명하고자 하였다. 또한 이들을 실내배양체로 확립하여 수온과 염분에 따른 생장률을 측정하여 이들 종주의 서식 가능한 온도와 염분 내성범위를 조사하였다.
2. 재료 및 방법
본 연구는 2017년 4월 5일에 제주도 주변 해역에서 7개의 연구정점(협재, 이호테우, 함덕, 성산, 표선, 남원, 사계)을 선정하여, 간조 시 조하대에서 시료를 채집하였다(Fig. 1). 각 연구 정점에서 수온과 염분은 YSI (Pro30, YSI Inc., OH, USA)를 이용하여 측정하였고, 시료 채집은 각 정점마다 무작위적으로 4~7종의 해조류를 수중에서 줄기 부분을 잘라 주변 해수가 들어 있는 지퍼백에 넣어 채집하였다. 채집한 시료는 아이스박스에 보관하여 바로 실험실로 옮겨 다음과 같은 전처리 과정을 수행하였다. 각 정점에서 채집한 시료는 지퍼백에 들어 있는 해수와 함께 1L 폴리에틸렌 샘플병에 옮겨 해조류에 부착된 와편모류를 해조류에서 탈착시키기 위해 3분 동안 약 250회 정도 강하게 흔든 다음, 253μm mesh로 걸러 해조류 잔해와 불순물을 제거하고 20μm mesh로 회수하여 최종 100 ml이 되도록 농축시켰다. 농축된 시료 100 ml를 50 ml Falcon 튜브 두 개에 나누어 담은 후, 그 중 하나는 최종 농도 2%가 되도록 글루타르알데하이드(glutaraldehyde)를 첨가하여 고정한 다음, 분석 시까지 냉장 보관하였고, 다른 하나는 세포분리와 단일배양을 위해 배양기에 보관하였다. 착생 와편모류를 탈착시킨 해조류는 수동원심분리기를 이용해 탈수하여 남은 물기를 제거하고 습중량을 측정한 다음, 분류 동정을 위한 표본을 제작하였다. 해조류의 동정은 한국동식물도감 해조류편(Kang, 1968)을 이용하여 분류하였다. 각 정점에서 저서성 착생 와편모류의 세포밀도를 계수하기 위해서 고정한 시료를 5~10회 반복 계수하여 해조류 단위 무게당(습중량, g) 착생 와편모류의 출현밀도(cells/g)를 산출하였다.
위에서 농축한 생시료에서 와편모류 Ostreopsis를 Capillary 피펫을 이용하여 단일 세포로 분리한 후 멸균 여과해수를 이용하여 3~5번 세척한 다음, 염분 30의 f/10 배지를 첨가하여 온도 20°C와 광량 160μmol m-2s-1의 14:10 h (L:D) 광주기 조건에서 배양하였다.
단일 배양한 와편모류 Ostreopsis의 세포 크기를 측정하기 위하여 2% glutaraldehyde로 고정한 시료를 1 ml씩 Sedgwick-Rafter 챔버에 분취하여, 광학현미경(Zeiss AXIO IMAGER A1)에 장착된 디지털 이미지 촬영장치(AxioCam)를 이용하여 30개의 세포를 검경하여 촬영한 다음, 각 세포의 길이(DV, dosal-ventral length; W, trans-diameter)를 측정하였다. 또한, 세포의 갑판배열을 확인하기 위해 Calcofluor White M2R을 이용하여 최종농도가 10μgml-1 로 염색한 후, 형광현미경의 푸른색 필터 여기파장 하에서 400배율과 1000배율로 검경하였다.
와편모류 Ostreopsis 성장률 실험은 6개 온도조건(10°C, 15°C, 20°C, 25°C, 30°C, 35°C)과 4가지 염분조건(20, 25, 30, 35)의 조합으로 총 24개 조건에서 세포 배양기(SW-90B2, Gaon sci., Korea)를 이용하여 수행하였다. 30 미만의 염분은 증류수로 희석시켜 제조하였으며, 35와 40의 고염분은 해수를 가열하여 증발시킨 후 제조하였다. 실험에 이용된 배양체는 각 실험 온도 및 염분에서 서서히 적응시킨 후 진행하였다. 각 조건에 적응된 배양체는 20 cells/ml의 농도가 되도록 희석한 다음, 10 ml 유리 시험관(Kimble chase, USA)에 5 ml씩 분취하였다. 각 실험구는 2일 간격으로 형광광도계(10-AU, Turner Designs, USA)를 이용하여 in vivo chlorophyll a 형광 값을 측정하였으며, 측정 직전 시료를 암실에서 10분간 안정시킨 후 형광값을 측정하였다. 형광 값과 실제 계수한 세포수와의 회귀분석을 실시하였을 때, 유의한 높은 상관관계를 나타내었기 때문에(r2=0.9995, p<0.0001), 각 수온과 염분 조건에서 측정한 in vivo chlorophyll a 형광 값을 이용하여 지수성장기의 세포 생장률(d-1)을 다음의 식 (1)을 이용하여 계산하였다.
| $$\mu=\frac1t\ln\frac{N_t}{N_0}$$ | (1) |
μ는 생장률(specific growth rate, d-1)이며, N0와 Nt 지수성장기에서 초기와 t시간(day) 후의 세포밀도를 말한다. 생장률에 대한 수온과 염분의 영향을 규명하기 위해 SPSS 10.0 (SPSS, Chicago, IL, USA)를 이용하여 이원분산분석(two-way ANOVA)을 실시하여 통계학적 유의성을 검증하였다.
저서성 와편모류 Ostreopsis의 유전자 분석을 위하여 도립현미경하에서 단일 세포로 분리한 다음, 멸균한 여과해수로 2~3번씩 세척하여 200㎕ PCR tube에 담은 후, 분석 시까지 초저온 냉동고(-80°C)에 보관하였다. DNA 추출을 위해 각 시료에 proteinase K를 1㎕씩 첨가한 다음, 95°C에서 10분 동안 반응시켰다. Promega PCR kit를 이용해 5X Green GoTaq Reaction buffer 4㎕, dNTP Mix 10nM 0.4㎕, Forward primer 6㎕, Reverse primer 6㎕, 증류수 1.1㎕, GoTaq DNA polymerase 0.5㎕로 총 20㎕의 mixture volume을 맞추었다. 이 때 primer는 LSU rDNA의 D8/D10영역을 증폭하기 위해 FD8, RB primer를 사용하였다(Chinain et al., 1999). PCR cycling은 95°C에서 initial denaturation를 4분, 95°C에서 20초, 55°C에서 30초, 72°C에서 30초의 40cycle, 72°C에서 final extension을 6분동안 유전자증폭장치(PCR thermal cycler)를 이용하여 수행하였다. PCR products는 DNA Clean & Concentrator TM-5 Kit (ZYMO RESEARCH, USA)를 사용해 정제한 다음, 3730xl DNA analyzer (Applied Biosystems, Foster City, CA, USA)을 이용하여 염기서열을 분석하였다. 염기서열은 ContigExpress (Vector NTI ver. 10.1, Invitrogen, Grand Island, NY) 프로그램을 이용하여 양방향 염기서열 데이터를 교차분석 후 단일 염기서열(contig)을 만들어 GenBank (Accession no. MK558223-MK558228)에 등록하였다.
본 연구에서 분석한 Ostreopsis종주의 염기서열자료는 NCBI (National Center for Biotechnology Information) GenBank (http://www.ncbi.nlm.nih.gov)의 BLAST 검색을 한 결과, 유사도를 통해 확인하였다. 유사도 분석결과를 바탕으로 본 연구해역에서 출현한 종들과 근연종의 염기서열을 다운로드하여 분자계통학적 분석에 이용하였다. 염기서열들은 ClustalX 1.83 (Larkin et al., 2007)을 이용하여 정렬하였고, 정렬된 자료는 다시 MaClade 4.08 (Maddison and Maddison, 2000)을 이용하여 유전정보의 정렬상태를 확인하고 수정하였다. 분자계통수 작성을 위해 전체 정렬된 염기서열 중에 94개 분류군과 831bp에 해당하는 자료를 바탕으로 RAxML 8.0 (Stamatakis, 2014)을 이용하여 2000회 반복 수행 설정으로 bootstrap을 적용하여 Maximum likelihood (ML) 분자계통수를 완성하였다. 또한 MrBAYES 3.2 (Ronquist et al., 2012)을 이용하여 Markov chain Monte Carlo (MCMC)과정을 2,000,000번 실시하여 Bayesian 분자계통수를 분석하고, 각 분기군에 대한 posterior probability (PP) 신뢰도 값을 구하였다.
3. 결 과
제주도 주변의 총 7개 연구 정점(협재, 이호테우, 함덕, 성산, 표선, 남원, 사계)에서 2017년 4월에 수온은 15.7~18.3°C의 범위를 나타내어, 정점 2에서 가장 높게 나타났고, 정점 5에서 가장 낮은 수치를 나타내었다(Table 1). 염분은 33.4~34.9의 범위를 나타내었으며, 정점 5에서 가장 높은 염분을 나타내었으며 정점 2에서 상대적으로 낮은 수치를 나타내었다(Table 1).
Table 1. Location, water temperature, and salinity at each sampling site during this study
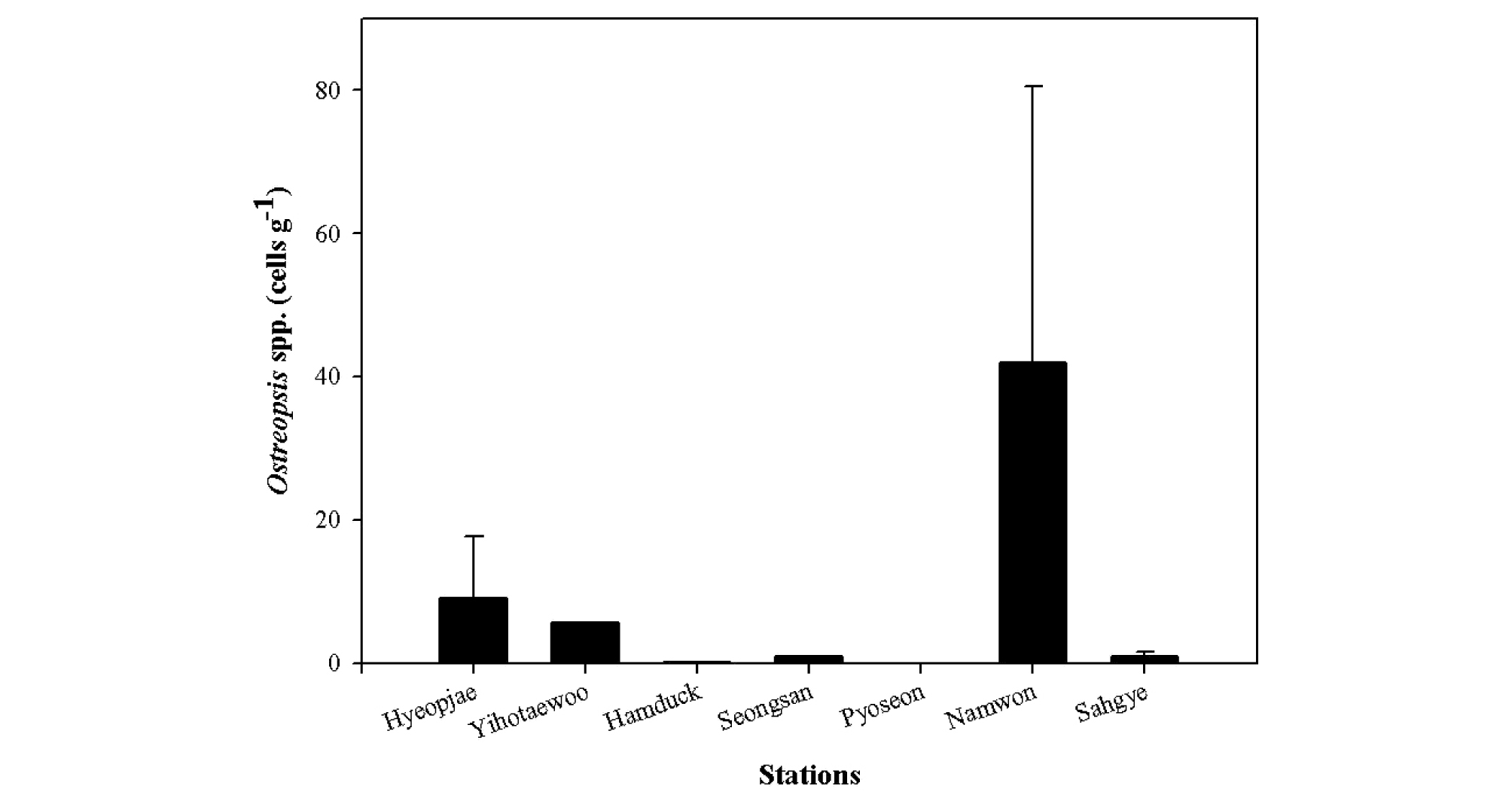
각 연구 정점에서 채집한 해조류는 전체 13종으로 동정되었으며, 이 중에서 홍조식물인 참지누아리(Grateloupia filicina)가 전체 연구 정점 가운데 4개 정점(1, 4, 6, 7)에서 채집되어 가장 많은 부분을 차지하였다(Table 2). 참지누아리를 포함하여 모두 8종의 해조류에서 착생 와편모류 Ostreopsis가 발견되었다(Table 2). 정점 6에서 채집한 참지누아리에서 해조류 단위 무게당 Ostreopsis의 출현밀도가 157.5 cells g-1로 가장 높은 농도로 출현한 반면, 정점 1과 4에서 채집한 참지누아리에서는 Ostreopsis가 발견되지 않았다(Table 2). 정점 3과 6에서 채집한 갈조식물 지충이(Sargassum thundergii)에서는 Ostreopsis가 출현하였으나, 정점 5에서 채집한 지충이에서는 Ostreopsis가 발견되지 않았다(Table 2). 정점별 전체 채집한 해조류 단위 무게당 Ostreopsis의 출현밀도(cells g-1)는 정점 6에서 채집한 해조류에서 평균 55.5 cells g-1로서 가장 높은 밀도로 출현하였고, 정점 5에서는 채집한 모든 해조류에서는 Ostreopsis가 발견되지 않았다(Fig. 2).
Table 2. Cell abundance of the benthic dinoflagellate Ostreopsis spp. on macroalgae collected from each sampling site along the coasts off Jeju Island, Korea during April 2017
본 연구에서 Ostreopsis가 출현한 정점 1, 3, 6, 7에서 단일세포로 분리하여 배양한 Ostreopsis 종주들의 LSU rDNA (D8/D10) 영역의 염기서열을 분석하였다. 분석된 모든 종주의 LSU rDNA (D8/D10) 영역의 염기서열은 모두 100% 동일한 것으로 나타났다. 본 연구에서 분리한 종주들과 GenBank에 등록된 Ostreopsis spp.의 같은 유전 영역에 해당하는 염기서열들을 정열하여 분자계통학적 분석을 실시한 결과, Ostreopsis spp.는 총 9개의 분기군(Species/clade)으로 분지되었으며, 각 분기군은 Ostreopsis cf. ovata, O. siamensis, Ostreopsis spp. 1-7로 나뉘어졌다. 이 중에서 제주 연안에서 분리한 Ostreopsis 종주들은 모두 Ostreopsis sp. 1 분기군내에서 단일 계통으로 분기하는 것으로 나타났다(Fig. 3).
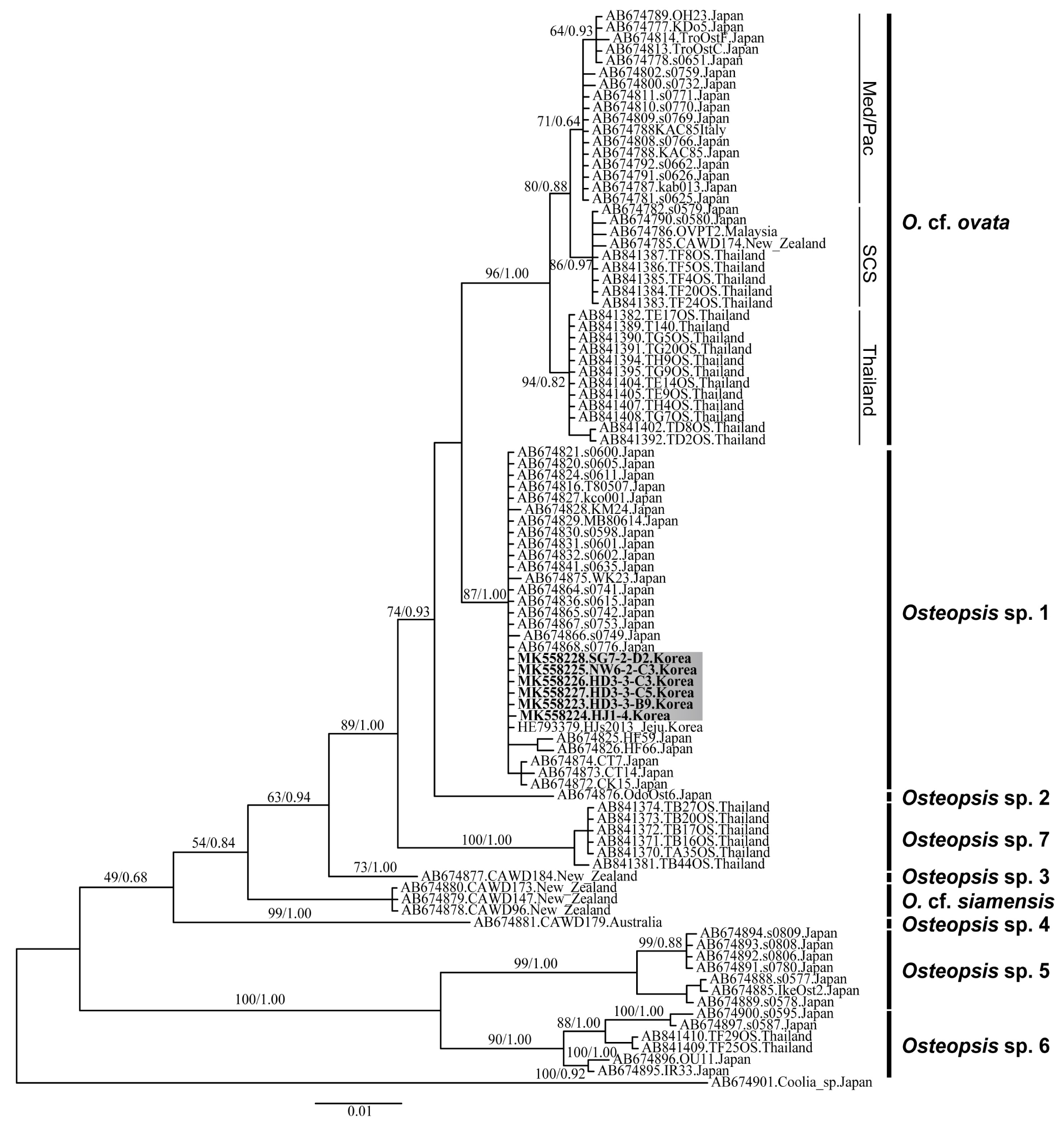
Fig. 3.
Bayesian phylogeny of Ostreopsis species inferred from 28S rRNA gene (D8/D10 regions). Med/Pac, SCS, and Thailand are the O. cf. ovata subclades collected from Mediterranean Sea and Pacific Oceans, South China Sea, and Thailand, respectively. Ostreopsis sequences collected from Jeju Island are represented in bold. Bootstrap supports (>50%) from maximum likelihood and Bayesian posterior probabilities (>0.60) are shown at nodes.
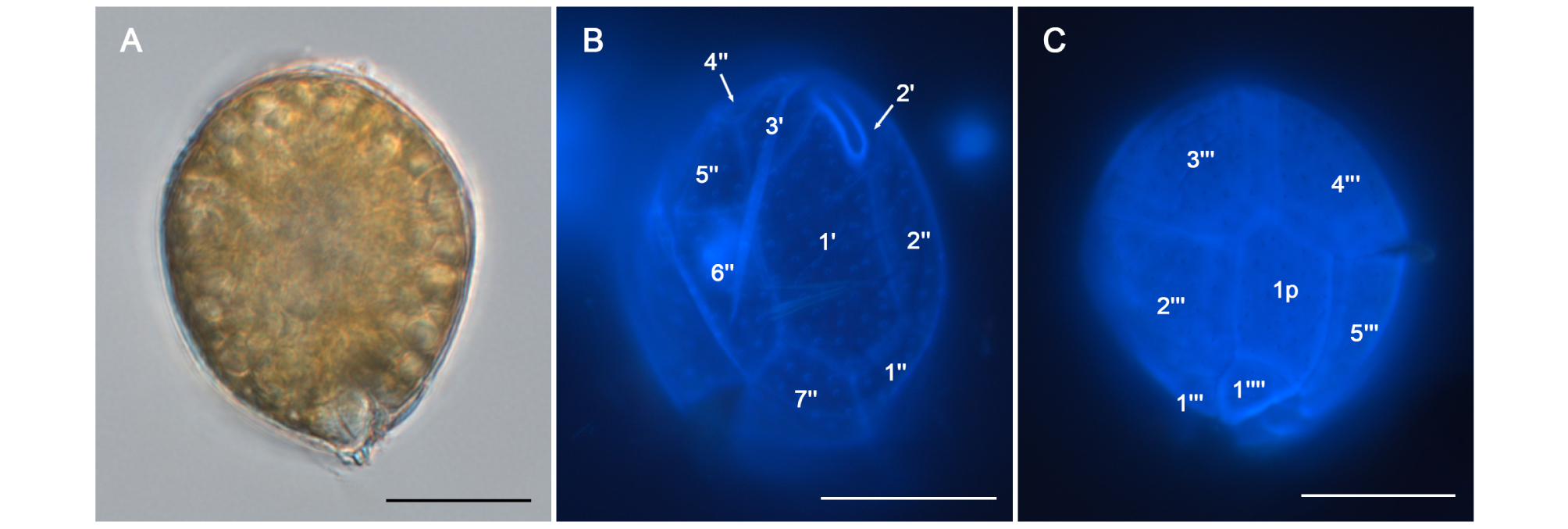
제주 연안에서 출현한 착생 와편모류 Ostreopsis 세포들을 광학현미경하에서 관찰한 결과, 세포 정단면(apical view)에서 황색계열의 광합성 색소체를 다량 함유한 물방울 모양(tear-shaped)의 전형적인 외형을 나타내었다(Fig. 4A). 이들의 갑판배열은 상단면(Epithecal view; Fig. 4B)에 Po, 1′, 2′, 3′, 1′′, 2′′, 4′′, 6′′, 7′′등이 관찰되었고, 하단면(Hypothecal view; Fig. 4C)에서는 1p, 1′′′, 2′′′, 3′′′, 4′′′, 5′′′, 1′′′′가 관찰되었다. Ostreopsis sp.1 (HP1-4)종주의 세포크기를 측정했을 때, 등배면 직경(Dorso-ventral diameter, DV)이 28-43μm의 범위로 평균 37.6±3.3 (mean±SE, n=30)으로 측정되었으며, 세포의 횡단면 직경(trans-diameter, W)은 19-30μm의 범위로 평균 25.6±3.2 (mean±SE,n=30)로 측정되었고, 등배면/세포횡단면 직경 비율(DV/W)은 1.34-1.74μm의 범위로 평균 1.8±0.1로 나타났다(Table 3). 본 연구 해역에서 분리한 Ostreopsis sp.1는 세포의 등배면(DV)과 횡단면(W)의 직경 및 그 비율(DV/W)의 평균적으로 제주 차귀도의 Osteropsis sp. 1 (O. cf. ovata, Korea) 종주와 유사한 것으로 나타났으며, 일본에서 분리한 Ostreopsis ovata species-complex 그룹인 Ostreopsis sp.1 과 O. cf. ovata 분기군에 속하는 종주들과 비교하여 다소 큰 것으로 나타났다(Table 3).
Table 3. Comparison of morphometric features between Ostreopsis sp.1 and O. cf. ovata subclades determined by light microscopy. Values represent as ranges (mean±standard deviation). DV, dorso-ventral diameter; W, trans-diameter
bRanges not mentioned.
cNot determined.
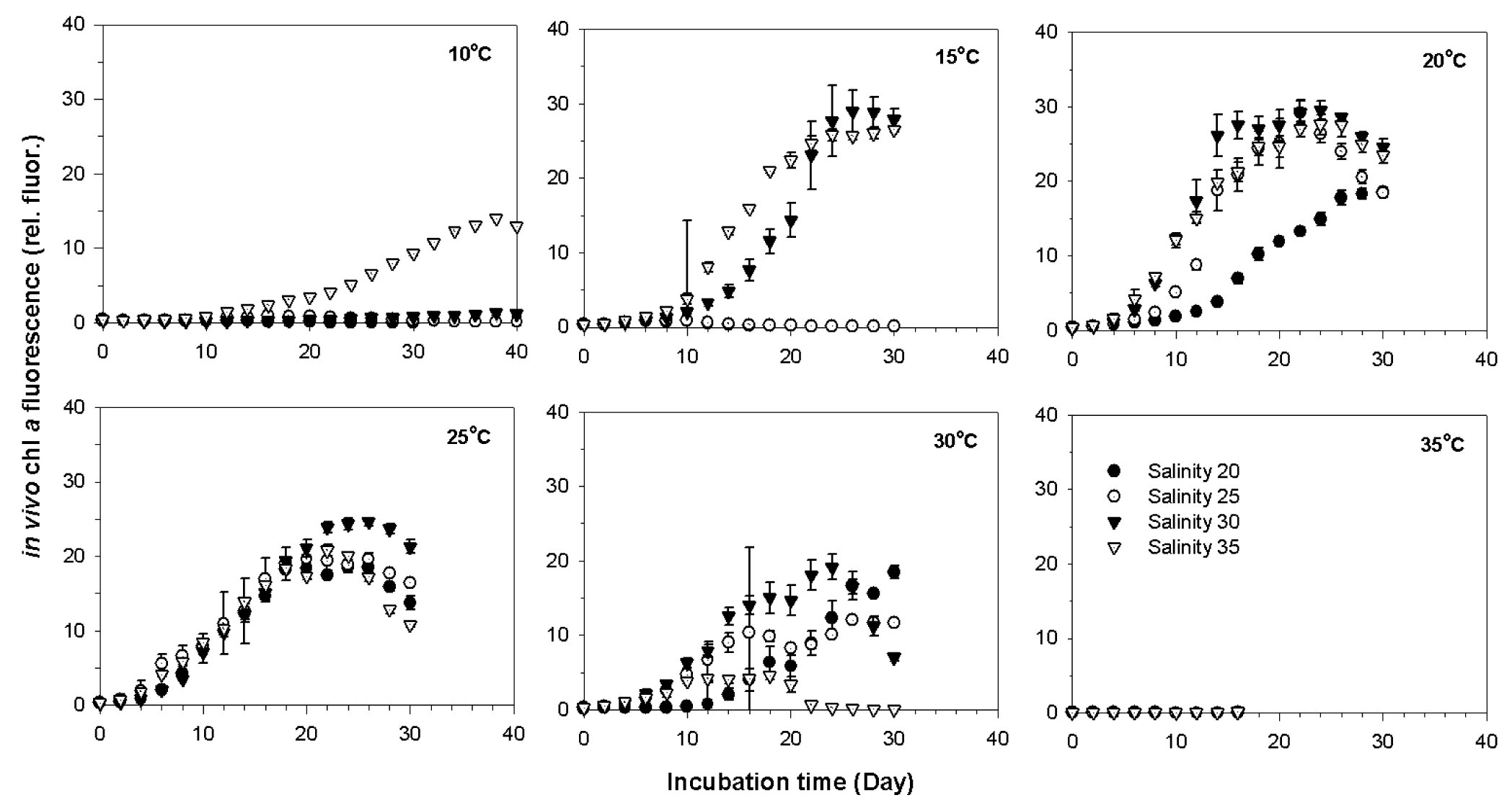
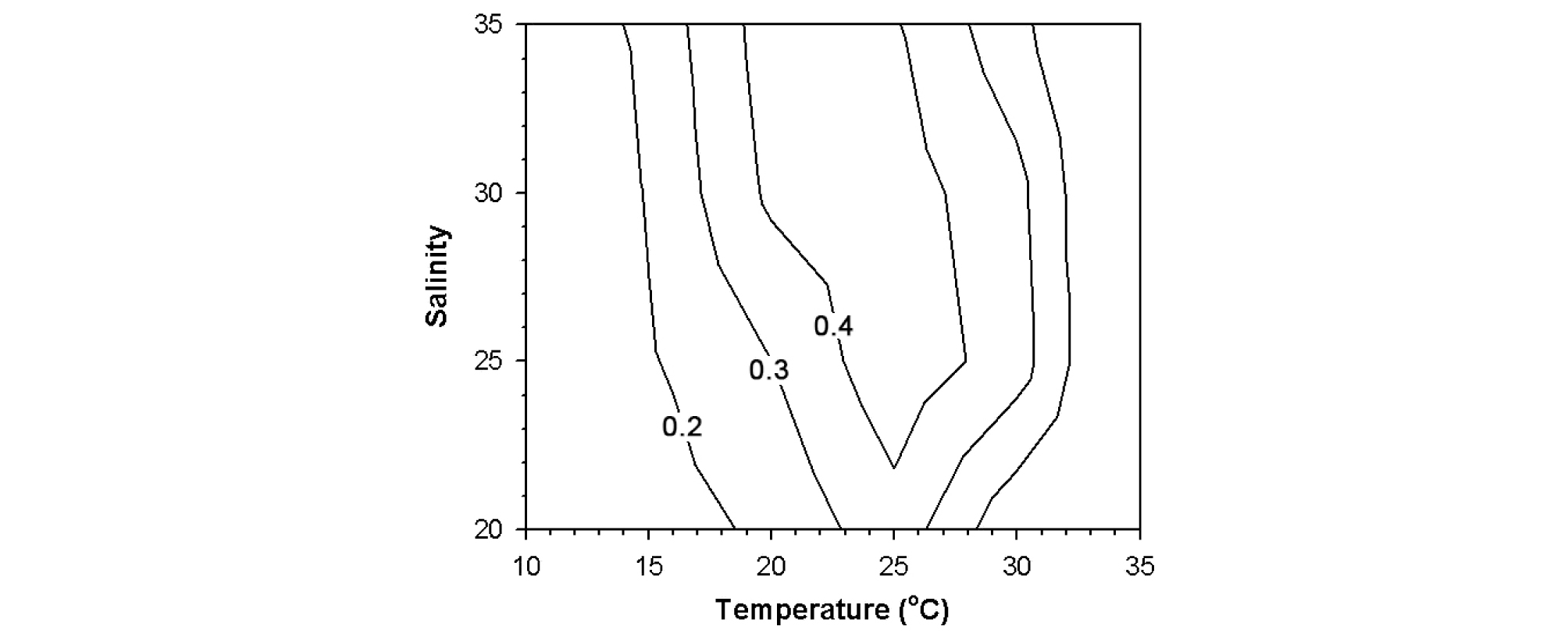
Ostreopsis sp. 1 (HJ1-4) 종주의 수온과 염분에 따른 세포밀도의 변화를 측정한 결과, 매우 넓은 온도 범위(10-30°C)에서 생장을 하는 것으로 나타났다. 10°C의 매우 낮은 수온에서도 생장을 보이며 내성을 나타내었으나, 35°C이상의 고온에서는 모든 염분 범위에서 유의한 생장을 보이지 않았다(Figs. 5, 6). 수온이 20-25°C인 조건에서는 모든 염분 범위에서 뚜렷한 세포밀도의 증가를 나타내었으며, 염분 25-35에서 가장 최적의 생장을 나타내었다(Figs. 5, 6). 수온과 염분에 따른 Ostreopsis sp.1의 생장률(d-1)은 수온과 염분이 증가할수록 점차 증가하면서, 수온 25°C와 염분 30에서 0.49d-1의 최대 생장률을 나타내었다(Figs. 5, 6). Ostreopsis sp.1의 생장률에 대한 수온과 염분의 영향을 이원배치분산분석(two-way ANOVA)을 수행한 결과, 수온, 염분, 수온과 염분의 상호작용 모두 Ostreopsis sp. 1의 생장률에 유의한 영향을 미친 것으로 나타났다(Table 4, p<0.001). 또한 SS (sum of squares)의 결과에서 염분보다는 수온이 Ostreopsis 생장률에 가장 큰 영향을 주는 것으로 나타났다(Table 4).
Table 4. Summary of a two-way ANOVA test for growth rates of Ostreopsis sp. 1(HP1-4) as a function of temperature and salinity
4. 고 찰
저서성 유독 착생와편모류 Ostreopsis는 열대, 아열대를 비롯하여, 온대 연안에 이르기까지 전 세계 연안에서 광범위하게 분포하는 것으로 알려져 있다. 우리나라에서는 제주 연안을 비롯하여 포항 연안에서 Ostreopsis의 출현이 보고된 바 있다(Kim et al., 2011; Baek et al., 2012; Lee and Park, 2018). 본 연구는 춘계(4월)에 제주 연안의 수온이 평균 약 16.8°C를 기록하였을 때, Ostreopsis의 최대 출현밀도가 157.5 cells g-1로 나타났다. 이는 Kim et al.(2011)이 보고한 추계(10월) 제주 연안의 수온이 평균 약 22°C일 때, 조사한 최대 밀도 8660 cell g-1와 비교하여 매우 낮은 수치라고 할 수 있다. 또한, Baek(2012)에 의해 11월 포항 연안에서 수온이 약 16°C일 때 조사한 결과에서는 Ostreopsis의 출현밀도가 최대 140 cells g-1를 나타내었으나, Lee and Park(2018)은 포항 연안의 연간 출현밀도의 변동을 조사한 결과에서는 7월 수온이 약 25°C일 때 최대 1588 cells g-1의 출현밀도를 나타내어, Ostreopsis의 출현양상이 계절과 지역에 따라 변동 폭이 매우 큰 것으로 나타났다. 특히, 이러한 지역은 쿠로시오 해류의 영향을 크게 받는 해역으로 수온과 염분의 변동이 이들의 생존과 생장률에 크게 영향을 미친 것으로 보인다.
Ostreopsis에 속한 많은 종들은 외형적으로 서로 매우 유사하며, 실내 배양을 할 경우에는 종주 내의 형태적인 변이가 증가하여, 현장 시료와 차이가 더욱 커지기 때문에 형태학적 특징을 기반으로 명확한 종 분류가 매우 어렵다(Penna et al., 2005). 따라서, 최근 Ostreopsis의 종 수준(분기군; clade)의 구분을 위해 유전자 마커를 이용한 분자계통학적 연구가 진행되어 왔으며(Penna et al., 2010; Sato et al., 2011; Tawong et al., 2014), 특히, LSU rDNA D8/D10영역을 이용한 분자계통수에서 Ostreopsis의 모식종(type species)인 O. siamensis를 비롯하여 O. cf. ovata와 Ostreopsis sp. 1-7의 총 9개의 종 수준의 명확한 분기군으로 나뉘어지는 것이 확인되었다. 이 가운데 O. cf. ovata, Ostreopsis sp. 1, Ostreopsis sp. 2 분기군에 속하는 종주들은 지리적인 분포에서 뚜렷한 차이를 나타내었지만, 형태학적으로 모두 O. ovata의 종 특징(갑판배열과 세포크기)에 부합되어 O. ovata 종 복합체(species-complex)로 간주되고 있다. O. cf. ovata 유전형에 속하는 종주들은 아열대와 온대 해역인 태국, 뉴질랜드, 말레이시아, 동중국해, 일본, 지중해 등의 비교적 넓은 해역에서 보고되었지만, Ostreopsis sp. 1 유전형은 일본에서 처음으로 보고한 이후, 우리나라를 비롯하여 일본, 러시아 등의 온대해역에서 출현이 보고되었다(Selina and Orlova, 2010; Sato et al., 2011; Lee and Park, 2018). 본 연구에서 우리나라 제주 연안에서 분리한 종주의 유전자를 분석한 결과 모두 Ostroepsis sp. 1 유전형에 속하는 것으로 확인되었으며, 현재까지 O. cf. ovata의 유전형에 속하는 종주들은 우리나라에서 출현이 보고되지 않았다. 또한, 최근 우리나라 포항 연안에서 Ostreopsis의 연주기 변동을 연구한 자료에서 출현한 종주들의 유전자 분석 결과도 모두 Ostreopsis sp. 1의 유전형에 속하는 것으로 나타났다(Lee and Park, 2018). 일부 연구결과에서 제주 차귀도에서 분리한 종주인 O. cf. ovata (accession no. HE793379)가 보고된 바 있으나(Kang et al., 2013), 본 연구에서 분리한 종주들의 유전자(LSU rDNA D8/D10영역)와 비교해 본 결과, 100% 동일한 염기서열을 나타내었고 분자계통수 분석에서 Ostreopsis sp. 1 유전형에 속하는 것이 확인되어 현재까지 국내에 출현하는 종으로 보고된 것은 모두 Ostreopsis sp. 1 유전형에 해당하는 것으로 확인되었다(Fig. 3). 우리나라와 가까이 위치한 일본의 경우에는 O. cf. ovata와 Ostreopsis sp. 1 두 가지 유전자 타입 모두 출현하였지만, O. cf. ovata는 지리적으로 일본의 중부와 남부(24–34°N, 123–134°E)에 걸쳐 주로 아열대해역인 오키나와 연안에서 분포하는 반면에, Ostreopsis sp.1은 일본의 북부에서 남부(27–44°N, 128–142°E)까지 일부 아열대 해역을 포함하지만 주로 온대해역인 규슈, 시코쿠, 혼슈 연안에서 분포하여, O. cf. ovata와 Ostreopsis sp.1는 출현하는 지리적 분포 범위에서 다소 차이를 나타내는 것으로 보고하였다(Sato et al., 2011; Tanimoto et al., 2013). 현재까지는 우리나라에 Ostreopsis sp.1 유전형만 보고되었지만, 기후변화에 의한 수온상승과 기질 부착성이 낮아 수주에 떠다니는 다른 아열대성 유전형의 종주가 해류를 통해 국내 유입 및 정착 가능성도 배재할 수 없으며, 추후에 체계적인 모니터링이 필요하다.
우리나라 제주 연안에서 분리한 Ostreopsis sp. 1의 종주의 수온과 염분에 따른 생장률의 변화를 측정한 결과에서 수온 25°C와 염분 30에서 가장 높은 생장률 0.49 d-1를 나타내어 Ostreopsis sp. 1은 온대해역에서 이미 적응한 종으로 볼 수 있다. 뿐만 아니라, 수온이 10°C인 저온에서도 염분 35일 경우에 뚜렷한 세포밀도의 유의한 증가를 나타내는 것을 확인하였으며, 이는 온대해역에서 수온이 10°C까지 낮아지는 시기에도 염분이 35인 외양수의 영향을 주로 받는 해역에서는 이들의 생존과 생장이 가능한 것을 시사한다. 따라서, 강우에 의한 염분 변동이 심한 반폐쇄적인 내만보다는 쿠로시오와 같은 외양수의 직접적인 영향을 받는 곳에서는 이들 종의 생존 및 생장에 있어서 더 유리할 것으로 판단된다. 특히, 본 연구 해역인 제주도는 연간 강수량이 높고 해저 지하수의 유출에 의한 영향이 크며 연간 염분 변동 폭이 높은 것으로 알려져 있어서(Hwang et al., 2012), 염분 변동과 더불어 해저지하수 유출에 따른 고영양염의 유입과 같은 환경요인이 Ostreopsis의 출현 분포에 미치는 영향에 대해서도 추후 연구가 필요할 것으로 판단된다. 본 연구 해역과 유사한 위도에 위치한 일본 Otsuki 연안(32°47′53N, 133°42′30E)에서 분리한 Ostreopsis sp.1 종주(accession no. AB674818)의 생장 특성에 대한 연구에서는 제주 연안에서 분리한 종주와 유사한 수온과 염분 내성범위를 나타내었지만, 수온 25°C와 염분 35에서 최대생장률이 0.55 d-1을 나타내어 우리나라 종주보다 다소 높게 나타났다(Tanimoto et al., 2013). 그러나, 아열대성 O. cf. ovata 종주의 최대생장률이 약 1.03 d-1 인 것에 비한다면 온대성 Ostreopsis sp.1 종주들의 최대생장률은 약 절반 정도 낮은 것을 알 수 있다(Yamaguchi et al., 2012). 이러한 수온이나 염분과 같은 환경 요인 이외에도 다른 요인들에 의해 이들의 생장에 영향을 미칠 수 있다. 최근 우리나라 포항에서 출현하는 Ostreopsis sp. 1종주의 세포 내에서 홍조식물 기원의 물질을 함유한 식포가 발견이 되어 혼합영양의 가능성을 제시한 바 있다(Lee and Park, 2018). 이전의 연구에서 보고된 바와 유사하게, 본 연구에서도 Ostreopsis가 다른 해조류에 비해 홍조식물에서 비교적 많이 출현하고 있었으며, 추후에 홍조식물에 대한 기질특이성과 혼합영양과의 관련성에 대한 연구가 필요하며, 많은 유해 조류 대발생을 유발하는 와편모류가 혼합영양성이라는 것을 감안한다면, 이러한 혼합영양성이 이들 생장률에 미치는 영향에 대해 추가적인 연구가 필요할 것으로 사료된다.
많은 와편모류에서 형태적 특징을 기반으로 한 전통적인 분류와 유전형과의 불일치가 보고되었으며(Scholin et al., 1994; Penna et al., 2005), 서로 다른 유전형의 lineage에 속하는 종주에 대한 새로운 종명을 부여하는 데에는 신중함을 기해야 한다. 제주 차귀도에서 분리한 O. cf. ovata(Ostreopsis sp. 1 유전형)의 전자현미경을 이용한 연구(Kang et al., 2013)에서 기존의 O. ovata의 문헌과 비교하여 일부 형태학적 차이(예, 횡구의 모양, 횡구 갑판의 수, Po 갑판에서 작은 knob 형태의 일련의 선)에 대해 보고한 바 있다. 이러한 차이가 Ostreopsis sp. 1 종주에서 공통적으로 나타나는 대표적인 형태적 특징으로 O. ovata 종과 구별할 수 있는 분류학적 특징인지에 대해 검토가 필요하며, 분자계통수 분석을 통해 규명된 다양한 유전형의 각 Ostreopsis 분기군에 대한 신종 명명에 대해서는 보다 정밀한 연구 자료의 축적과 비교가 필요할 것으로 판단된다.