1. 서 론
광양만은 전라남도 여수시와 광양시 남부에 있는 남해안의 대표만으로써, 하천 유입량은 북부의 섬진강 및 수어천을 통해 연간 약 5.8 ~ 8.7 × 108 톤의 담수가 유입되며, 해수 교환량은 진주만과 연결된 노량수로 및 여수해협을 통해 약 2.7 × 109 톤이 된다(한국해양과학기술원, 2010). 묘도를 중심으로 북측에는 80년대 조성 된 광양제철소와 그 연관 산업단지가 위치해 있으며, 남측은 70년대 말에 석유화학공업을 중심으로 형성된 여수 국가산업단지가 위치해 있고, 만의 서측은 율촌 산단이 조성 중에 있다. 이러한 공단 및 항만의 개발은 광양만의 지형을 상당부분 바꿔놓았다(유 등, 2008). 이러한 산업시설을 건설하기 위하여 간척사업과 항로개설에 따른 수로의 준설로 조류의 특성을 변화시켜 해저퇴적상의 변화를 초래하고, 그 결과 저서생물의 분포에 직‧간접적으로 영향을 미치는 것으로 알려지고 있다(Choi and Koh, 1984; 신과 고, 1990). 또한 장기적인 매립과 개발이 진행 중이거나 계획 중에 있어 이로 인한 생활하수 및 공단 지역의 다양한 오폐수 유입으로 연안 환경에 심각한 훼손의 우려가 있어 정부는 1982년부터 울산 연안, 부산 연안 및 진해만과 특별관리해역으로 지정하였다(한국해양연구원, 2003).
광양만에서 진행된 저서생태계 연구로는(Choi and Koh, 1984; 신과 고, 1990; 정 등, 1995, 정 등, 1997; 최 등, 2003; 임 등, 2012)등이 연구되어져 왔으며, 대부분의 연구가 대형저서동물의 군집특성에 관한 연구에만 국한 되어져왔다. 이렇듯 그동안 국내에서 저서생태계를 평가하기 위한 방법으로 대형저서동물(macrobentos)의 생태적인 특성을 활용한 연구가 활발히 진행된 반면 중형저서동물(meiobentos)의 국내 연구는 미약한 실정이다.
중형저서동물이 저서생태계 내에서 차지하는 중요한 역할은 높은 서식 밀도로부터 쉽게 이해할 수 있다. 중형저서동물은 저서생태계 내에서 높은 서식밀도(일반적으로 천해계의 퇴적물에서 약 10-5 ~ 10-6 ind.10 m-2), 빈영양의 해역에 있어서도 10-4 ~ 10-5 ind.10 m-2 정도의 밀도를 유지하고 있다(Shirayama, 1984). 이와 같은 높은 서식밀도로 인하여 이들을 섭취하는 대형저서동물과 어류의 군집조성에 많은 영향을 미친다. 또한 대형저서동물에 비해 짧은 기간에 환경의 변화에 따른 군집변화를 보인다고 알려져 있으며(Sandulli and De Nicola, 1990), 조사방법상에 있어서도 극히 적은 시료채취만으로도 분석이 가능하여 시료채취로 인한 자연 환경의 훼손이 적게 나타난다(Moore and Bett, 1989). 중형저서동물은 서식환경에 있어서 퇴적물에 대한 높은 의존도 때문에 저서환경 오염의 영향 연구에 이상적인 생물로 인식되고 있으며(Coull and Chandler, 1992), 환경 평가의 척도로서 국외에서는 중형저서동물에 대한 많은 연구가 진행되어져왔다. 본 연구에서는 중형저서동물의 생태적 특성을 활용하여 저서생태계 군집분포를 파악하고자 하였다. 특히, 일반적인 중형저서동물의 계절적인 서식밀도 분포 양상은 겨울에 낮은 온도 등으로 인하여 전체 서식밀도가 감소하는 경향이 나타나며, 여름에는 높은 서식밀도를 나타내는 경향이 있다(James and Mark, 2004). 광양만에서 중형저서동물의 군집변화가 이러한 일반적인 계절적 변동을 반영하는지와 군집특성에 영향을 주는 환경요인은 무엇인지 파악하여 현재까지 국내에서 소외되었던 중형저서동물 군집을 통한 광양만의 저서생태계 특성을 파악하고자 하였다.
2. 재료 및 방법
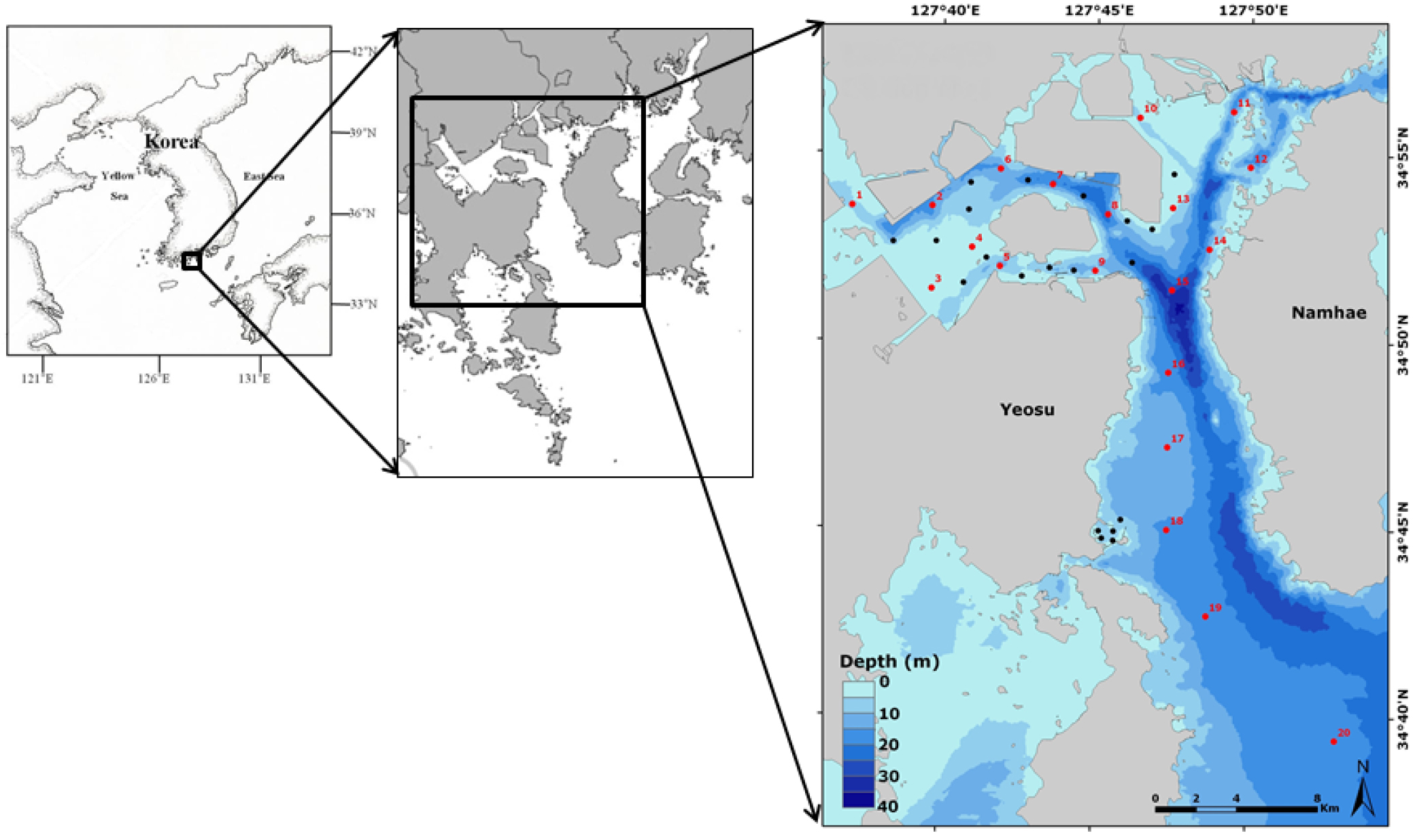
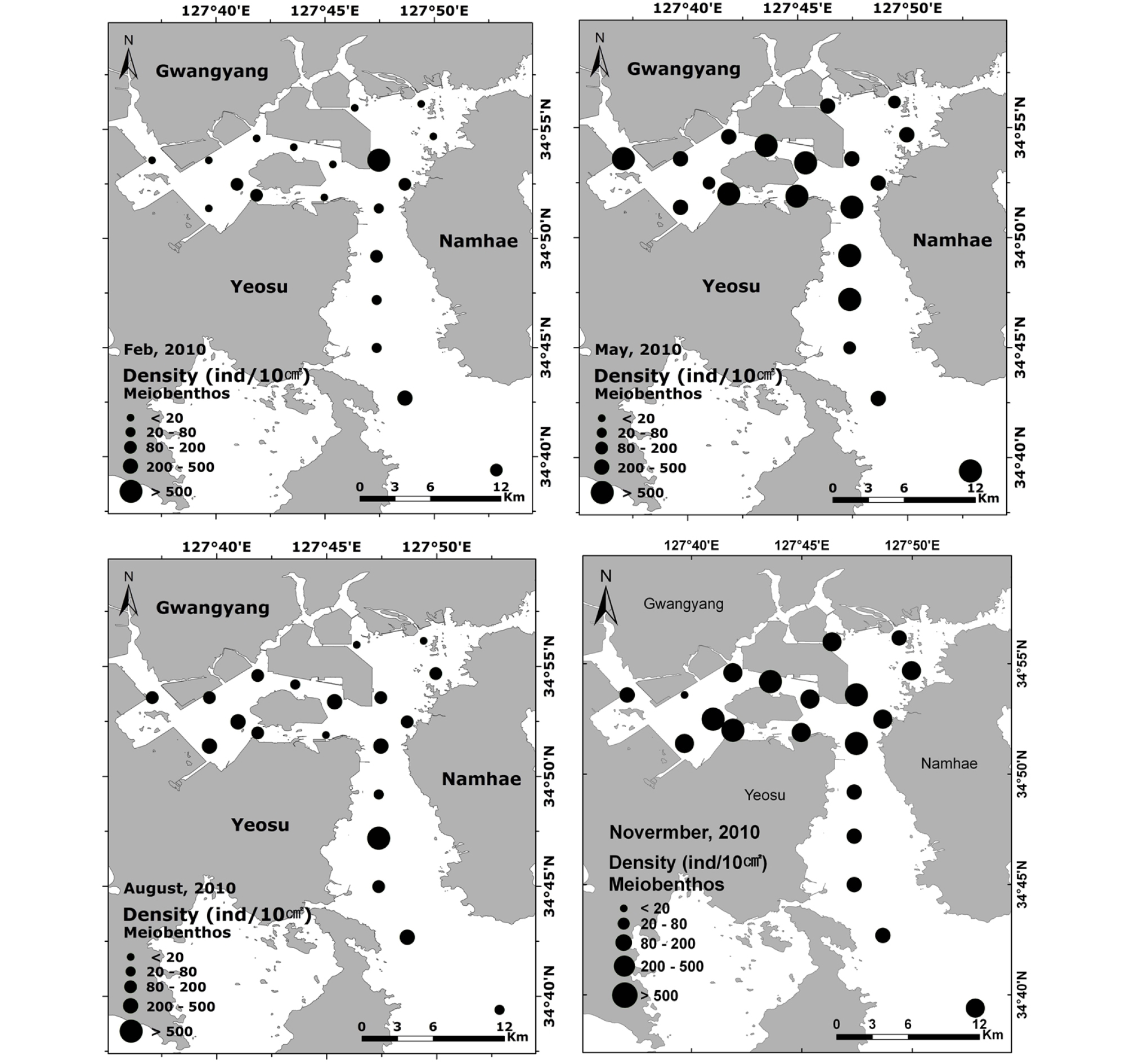
광양만 주변 해역에 서식하는 중형저서동물 군집구조 연구를 위해 2010년과 2011년에 총 8회에 걸쳐 20개 정점에서 시료를 채집하였다(Fig. 1). 조사기간 동안 정점의 위치는 보다 정확성을 기하기 위하여 Garmin사의 GPS를 이용하여 기록하였으며, 각 정점에서의 채집은 대부분 반경 10 m 내에서 위치하도록 하였다(Table 1).
Table 1. Position of sampling station in study area
시료 채집은 Smith-McIntyre grab과 van Veen grab을 이용하여 퇴적물 시료를 채집하고, 직경 3.6 cm 크기의 아크릴로 된 튜브를 이용하여 각 정점 당 3개의 반복시료를 채집하였다. 채집된 퇴적물 시료는 로즈 벵갈(rose bengal)을 혼합한 5% 중성포르말린으로 고정하여 연구실로 운반하였다. 운반되어진 시료는 실험실에서 1 mm 체를 통과하고 37 ㎛ 체에 남겨진 시료에 Silica-gel Ludox HS-40를 넣고 밀도차이에 의한 생물 분리 방법을 이용하여 중형저서동물을 퇴적물과 분리하였다(Robert, 2001). 퇴적물과 분리된 중형저서동물은 각 크기의 체(500 ㎛, 250 ㎛, 125 ㎛, 63 ㎛, 37 ㎛)로 걸러내어 해부현미경 하에서 계수하였고, 광학현미경 하에서 동정, 분류하였다. 생체량 분석은 Shirayama(1983)의 중형저서동물 주요 분류군별 개체당 ash free dry weigh (㎍) 환산 값을 사용하였다.
각 정점의 군집 다양도를 평가하기 위한 다양도지수(Diversity Index)는 Shannon and Wiener(1963)에 의하여 구하였으며, 채집 시기별로 중형저서동물의 군집구조를 파악하기 위하여 Bray-Curtis의 유사도지수를 기초로 집괴분석을 실시하였다. 소수 출현분류군에 의한 유사도지수의 과대평가를 낮추기 위해 모든 자료는 square root로 변환하였으며, 중형저서동물의 출현 분류군별 서식밀도를 기초로 nMDS (non-metric multidimensional scaling)을 실시하여 군집특성을 분석하였다. 그리고 각 그룹 별 군집차이를 나타나게 하는 중형저서동물 분류군을 파악하기 위해 SIMPER (Similarity Percentage) 분석을 수행하였다. 분석시 기여도가 높은 상위 5개 분류군을 기준으로 선정하였으며, 또한 중형저서동물의 환경특성과 군집특성간의 상관관계를 파악하고자 비모수 통계기법(non-parametric)인 spearman rank correlation coefficient를 사용하여 상관성 분석을 실시하였다. 집괴분석, nMDS, SIMPER, 분류군 다양도 분석은 Primer (v. 5.2)를 이용하였으며, 상관관계 분석은 SPSS (v. 12.0)을 이용하였다. 그리고 환경특성 자료는 남해특별해역 생태계 건강지수 개발 보고서(한국해양과학기술원, 2010; 한국해양과학기술원, 2012)의 자료를 인용하였다.
3. 결과 및 고찰
3.1 서식환경
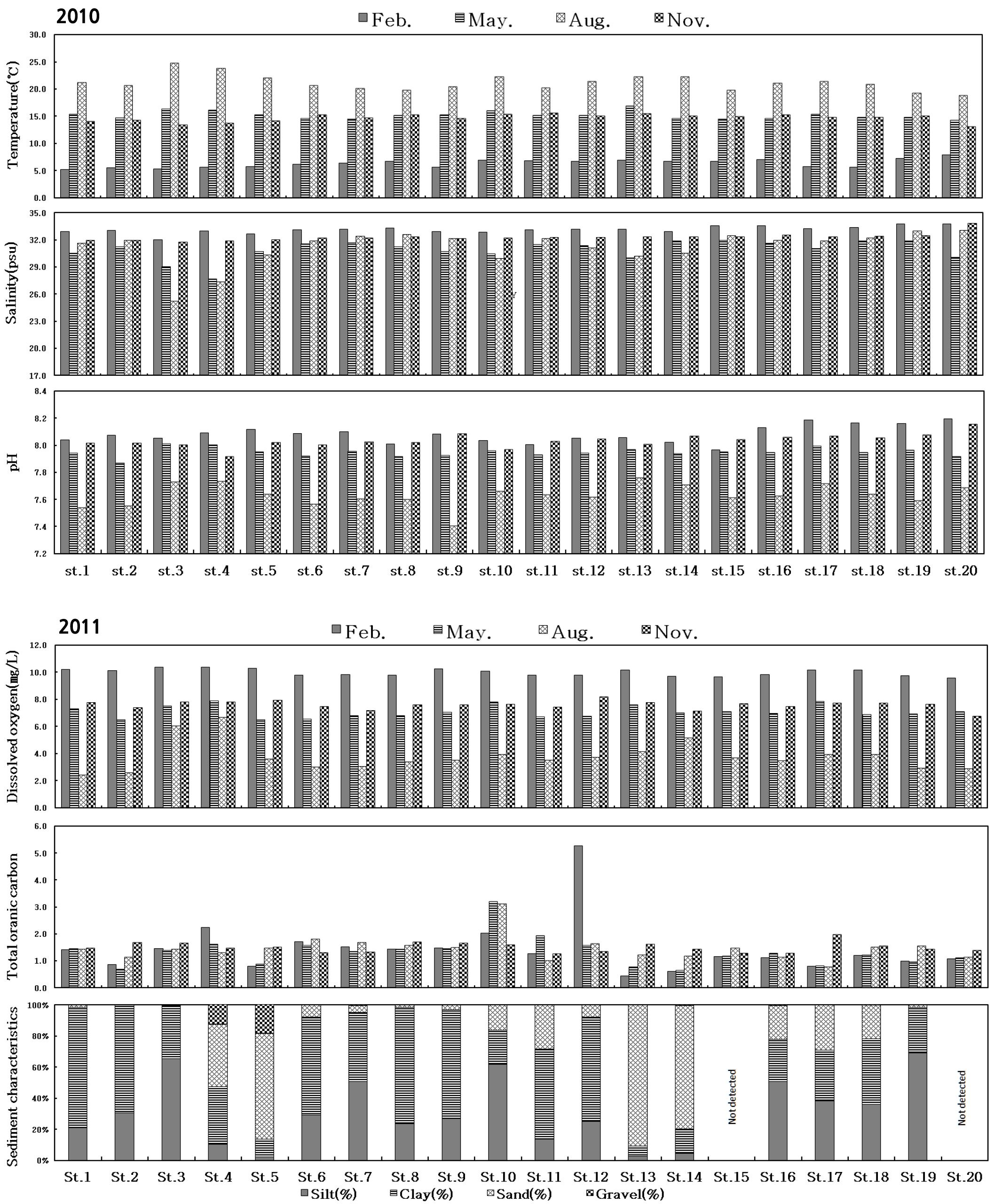
광양만의 계절별 표층과 저층의 수온, 염분, pH의 변화는 Fig. 2와 같다. 저층 수온의 계절변동은 겨울에 수심이 가장 얕은 만의 서쪽 주변지역에서 가장 낮았으며 수심이 가장 깊은 만 입구 주변지역에서 가장 높게 나타났다. 반면 수온이 상승하는 봄부터 가을까지는 수심이 가장 깊은 만 입구 주변지역에서 가장 낮았으며 만의 내측 주변지역에서 가장 높게 나타났다. 계절별로 평균 6.3 ∼ 21.2℃의 범위를 나타냈으며, 겨울에 평균 6.3℃로 가장 낮은 수온을 나타냈고 봄에 평균 15.2℃, 여름에 가장 높은 평균 21.2℃를 나타냈다. 가을엔 봄과 유사한 14.7℃를 나타냈다(Fig. 2).
저층 염분의 계절변동은 전 계절에서 수심이 얕은 광양만 서부 내만역 지역이 낮은 염분을 나타냈으며, 수심이 깊은 만의 최외각 지역에서 높은 염분을 나타냈다. 계절별로 평균 30.9 ∼ 33.1 psu 범위를 나타냈으며, 계절별 평균 염분은 강우량이 많았던 봄과 여름에 각각 30.9, 31.2 psu로 낮은 염분을 나타냈고 가을과 겨울에는 각각 33.1, 32.3 psu로 유사한 염분을 나타냈다(Fig. 2).
저층 pH의 계절변동은 계절별로 평균 7.63 ∼ 8.15 범위로 광양만 서부 내만역과 주수로역, 여수해만 지역이 큰 차이를 나타내지 않았다. 계절별 평균 pH는 봄과 여름에 각각 7.95, 7.63으로 낮은 pH를 나타냈고 가을과 겨울에 각각 8.08, 8.04로 유사한 pH를 나타냈다(Fig. 2).
저층 용존산소의 계절변동은 겨울에 9.56 ∼ 10.36 ㎎/ℓ 범위로 만의 최외각 정점에서 9.56 ㎎/ℓ로 가장 낮았으며 서부 내만역과 주수로역 정점에서 10.36 ㎎/ℓ로 가장 높게 측정되었다. 봄은 6.50 ∼ 7.88 ㎎/ℓ 범위로 겨울에 비해 용존산소가 감소하여 서부 내만역 정점 2에서 6.50 ㎎/ℓ로 가장 낮았으며 인접한 묘도 남측수로 정점 4에서 7.88 ㎎/ℓ로 가장 높게 측정되었다. 여름은 2.42 ∼ 6.68 ㎎/ℓ 범위로 조사기간 중 가장 낮은 용존산소를 나타냈으며, 서부 내만역 정점 1에서 2.42 ㎎/ℓ로 가장 낮았으며 인접한 묘도 남측수로 정점 4에서 6.68 ㎎/ℓ로 가장 높게 측정되었다. 가을에는 소폭 증가하여 6.77 ∼ 8.18 ㎎/ℓ 범위로 만의 최외각 정점 20에서 6.77 ㎎/ℓ로 가장 낮았으며 주수로역 정점 12에서 8.18 ㎎/ℓ로 가장 높게 측정되었다. 계절별 평균 용존산소는 여름에 3.79 ㎎/ℓ로 가장 낮은 값을 나타냈고 봄과 가을에 각각 7.09, 7.59 ㎎/ℓ로 유사한 용존산소 값을 나타냈으며 겨울에 9.98 ㎎/ℓ로 가장 높은 값을 나타냈다(Fig. 2).
퇴적물 내 유기물의 계절변동은 겨울에 0.43 ∼ 5.27 범위로 주수로역 정점 13에서 0.43으로 가장 낮았으며 인접한 정점 12에서 5.27로 가장 높게 측정되었다. 봄은 0.64 ∼ 3.19 범위로 정점 14에서 0.64로 가장 낮았으며 정점 10에서 3.19로 가장 높게 측정되었다. 여름은 0.75 ∼ 3.10으로 정점 17에서 0.75로 가장 낮았으며 주수로역 정점 10에서 3.10으로 가장 높게 측정되었다. 가을은 1.24 ∼ 1.68 범위로 정점 11에서 1.24로 가장 낮았으며 정점 8에서 1.68로 가장 높게 측정되었다. 계절별로 평균 1.31 ∼ 1.48의 범위를 나타냈다. 봄에 1.31로 가장 낮은 값을 나타냈고 겨울과 여름에 1.44로 같은 값을 나타냈으며 가을에 1.48로 가장 높은 값을 나타냈다. 정점별로는 광양만의 주수로역 정점들에서 퇴적물내 유기물 변동이 가장 높은 것으로 나타났다(Fig. 2).
퇴적물의 입도는 정점 1 ∼ 3, 6 ∼ 10, 12, 19는 Silt와 Clay의 함량이 90% 이상을 차지하였고 정점 5, 13, 14는 Sand의 함량이 70% 이상으로 나타났다. 그리고 정점 4, 11, 16 ∼ 18은 Silt, Clay, Sand가 혼합되어 나타나 광양만 내에서 인접한 정점들 간의 퇴적물 입도 함량이 다양한 분포를 나타내는 것으로 나타났다(Fig. 2).
3.2 중형저서동물의 군집 조성 및 주요 생물군
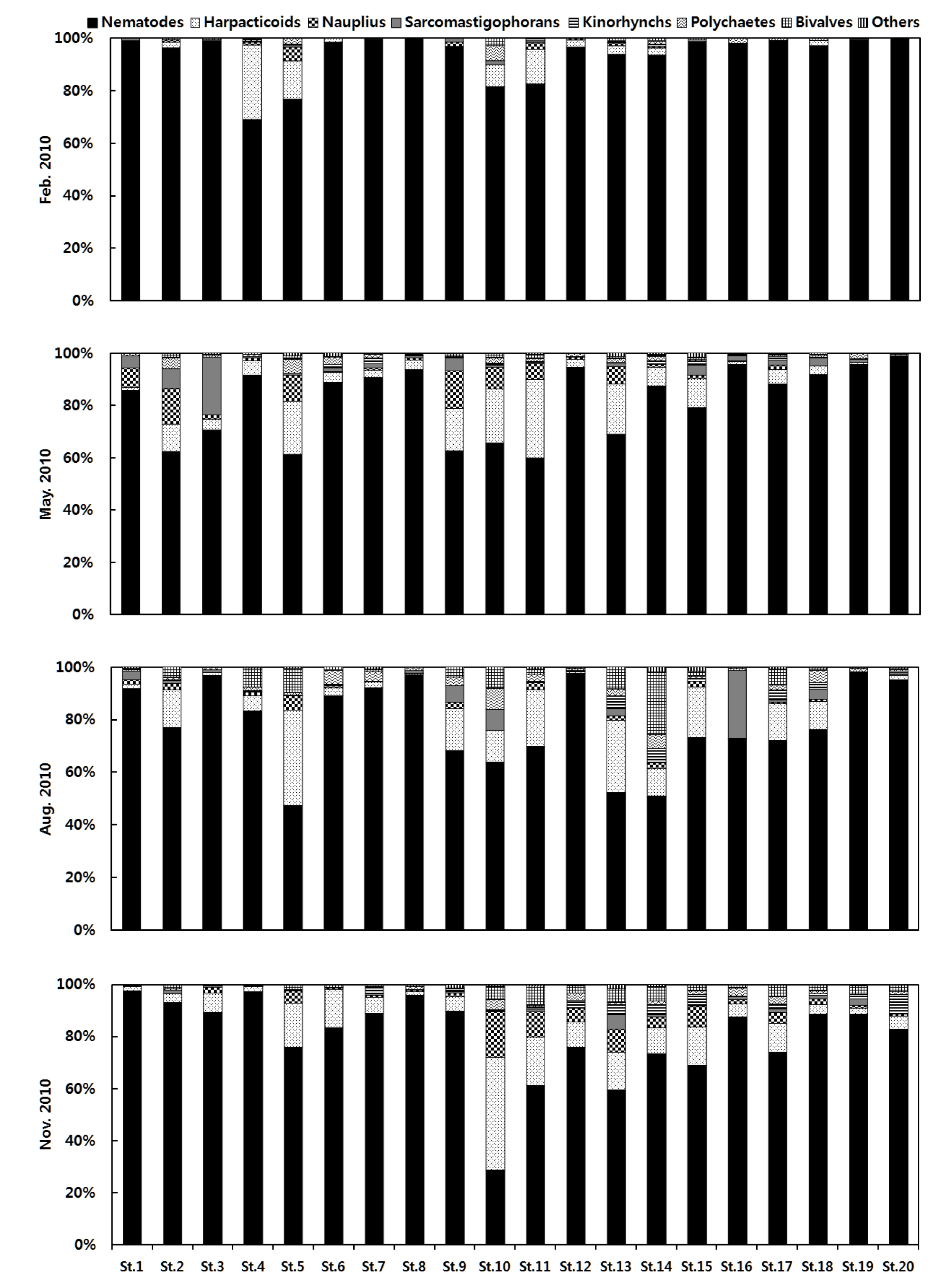
본 연구에서 출현한 중형저서동물의 정점별 우점 분류군 조성비 변화는 2010년 가을에 주수로역 정점 10과 2011년 겨울에 정점 11을 제외하고 선충류가 가장 우점하여 출현한 분류군으로 나타났고 다음으로 저서성 요각류가 높은 출현을 비율을 나타냈다(Figs. 3, 4). 일반적으로 선충류(nematodes)는 중형저서동물 그룹 중 다른 분류군 보다 서식밀도가 높고, 종 다양성 또한 높은 분류군으로 알려져 있다(James and Mark, 2004). 그러나 모든 지역에서 이처럼 선충류나 저서성 요각류(harpacticoids)가 우점하는 것은 아니며, 지역과 서식지의 특성에 따라 다소 차이가 있다. 선충류와 저서성 요각류 다음으로 유점한 분류군은 갑각류 유생(nauplius), 유공충(sarcomastigophorans), 다모류(polychaetes), 동문동물(kinorhynchs), 이매패류(bivalves) 순이며, 이들 분류군 조성비가 전체 서식밀도의 90% 이상을 차지하는 것으로 나타났다. 이러한 분류군 조성비는 남해 가막만에서 연구된 중형저서동물 군집구조와 유사한 분류군 조성비를 나타냈고(김 등, 2000; 이 등, 2016), 서해 장봉도 인근 사질 퇴적물에서 연구된 중형저서동물의 우점 분류군 조성비와는 다른 결과를 나타냈다(강 등, 2011).
각 정점에 출현한 중형저서동물의 군집 조성을 보면 2010년 겨울은 광양만의 서부 내만역 정점 4, 5와 주수로역 정점 10, 11을 제외한 모든 정점에서 선충류가 80% 이상을 나타냈다. 특히 광양만 서부 내만역(정점 1, 3), 묘도 북측수로(정점 7, 8), 여수해만(정점 15, 19, 20)의 일부 정점들은 선충류 외에 다른 분류군의 출현이 나타나지 않았다. 상대적으로 다양한 분류군이 출현한 광양만 묘도 남측수로 정점 4, 5와 주수로역 정점 10, 11은 모래의 함량이 높은 지역으로 저서성 요각류와 갑각류 유생 등이 높은 출현을 보인 반면 펄의 함량이 높은 서부 내만역(정점 1, 3), 묘도 북측수로(정점 7, 8), 여수해만(정점 19)은 선충류만이 출현하는 결과가 나타났다. 이러한 결과는 퇴적물이 펄로 이루어진 남해 가막만에서 선충류의 비율이 70 ∼ 80% 로 나타난 것과 비교하여도 높은 비율로 나타났다(김 등, 2000). 봄의 분류군 조성비를 보면 겨울과 비교하여 상대적으로 저서성 요각류와 갑각류 유생, 유공충이 높은 비율로 출현하였고, 수심이 가장 깊은 만의 최외각 정점 20을 제외하고 5 ∼ 10개 분류군이 출현하였다. 유공충류 또한 선충류, 저서성 요각류와 함께 천해뿐만 아니라 극한 환경인 심해에도 출현한다고 알려져 있어, 환경 적응력에서 유리한 종으로 알려져 있다(Shirayama, 1984; 김 등, 2000). 하지만 광양만 주수로역 정점 12와 최외각 정점 19, 20은 겨울과 비슷하게 선충류가 분류군 조성비에 90% 이상을 차지하는 결과가 나타났다. 여름의 분류군 조성비를 보면 겨울과 봄에 낮은 출현비율을 보인 이매패류 유생과 다모류 유생의 출현이 높게 나타났고, 정점 3, 8, 12, 19, 20은 선충류의 출현비율이 매우 높게 나타났다. 그리고 정점 5, 13은 저서성 요각류의 출현비율이 약 30% 이상으로 높은 출현비율을 나타냈다. 특히 정점 3, 8, 12, 19의 퇴적상은 펄의 함량이 90% 이상을 차지하였고, 정점 5, 13은 모래의 함량이 각각 68%, 90% 로 나타났다. 이러한 결과는 펄의 함량이 높은 곳에서 선충류가 우점하고, 모래 함량이 높은 곳에서 저서성 요각류가 우점하여 나타나는 일반적인 경향과 일치하였다. 가을의 분류군 조성비는 광양만 서부 내만역과 묘도 주변 정점 1 ∼ 9에서 선충류가 전체 서식밀도에 약 80% 이상을 차지하여 출현한 반면 비교적 외부로부터 해수의 유입이 원활한 지역인 정점 주수로역 10 ∼ 15는 상대적으로 선충류의 출현 비율이 감소하고 저서성 요각류와 갑각류 유생 등 다양한 분류군들이 출현하는 결과가 나타났다. 하지만 수심이 깊고 해수의 유속이 빠른 여수해만 및 최외각 정점 16 ∼ 20은 서부 내만역 정점과 유사한 분류군 출현비율을 나타냈다(Figs. 3, 4).
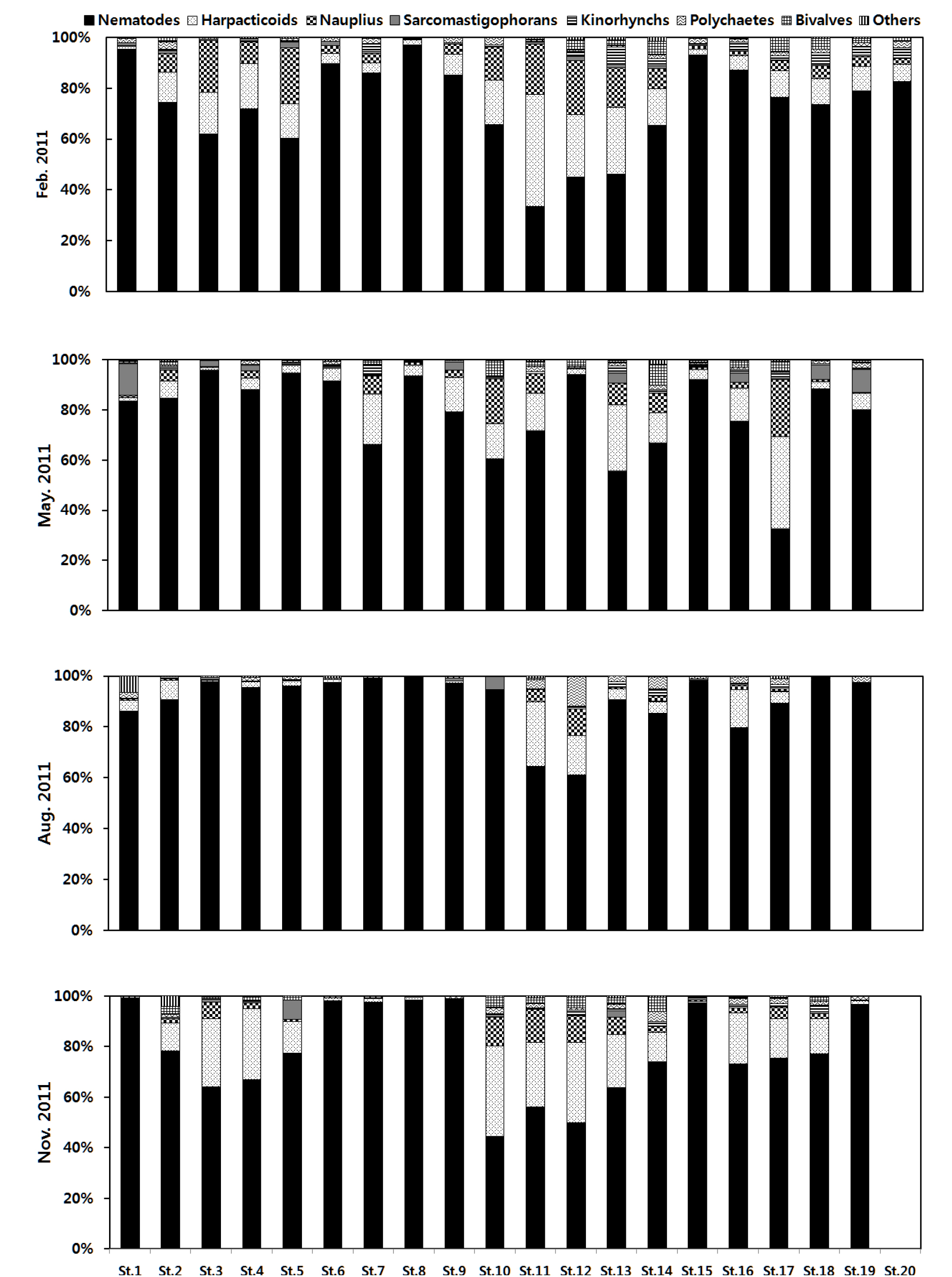
2011년 겨울의 우점 분류군 조성비는 2010년 겨울과 대비되는 결과가 나타났다. 광양만 서부 내만역 정점 1과 주수로역 정점 8, 15는 2010년 겨울과 분류군 조성비가 큰 차이를 보이지 않았지만 이를 제외한 모든 정점에서 저서성 요각류, 갑각류 유생, 동문동물 등 다양한 분류군이 출현하는 결과를 나타냈다. 특히 2010년에 낮은 출현 비율을 보인 저서성 요각류와 동문동물의 출현 비율이 높아졌다. 중형저서동물의 군집 조성이 변하는 원인으로 퇴적물의 입도, 용존산소, 온도의 변화가 대형저서동물의 군집변화와 마찬가지로 크게 작용을 하며(James and Mark, 2004), 크기가 대형저서동물에 비하여 매우 작은 중형저서동물의 경우에는 환경 요인에 의해 더욱 민감하게 반응을 나타내기 때문에 작은 환경변화에도 중형저서동물의 군집은 더욱 민감하게 반응 할 수 있다(Sandulli and De Nicola, 1990). 또한 육상으로부터 유입되는 유입물질과 인위적인 환경교란 등에 의해서도 중형저서동물의 군집은 영향을 받을 수 있다. 겨울철 군집변화 요인을 파악하기 위하여 환경특성과의 상관관계 분석결과 주요 우점분류군에서 저층 수온 및 평균 입도와 유의한 상관관계를 나타내어(p<0.01, p<0.05) 광양만의 겨울철 군집 변동은 저층 수온과 평균 입도와 같은 물리적 환경요인과 밀접한 관계가 있다고 판단된다. 봄의 우점 분류군 조성비는 정점 1, 19에서 유공충이 높은 출현을 나타냈고, 여수해만 정점 17에서 저서성 요각류와 갑각류 유생의 출현 비율이 전체 서식밀도에 약 60% 이상을 차지하는 높은 출현 비율을 나타냈다. 하지만 겨울과 비교하여 광양만 서부 내만역 정점 2, 3, 4, 5에서 선충류의 출현 비율이 증가하였다. 그리고 주수로역 정점 10, 13, 14는 저서성 요각류와 갑각류 유생이 겨울과 유사한 비율로 출현하였다. 여름은 주수로역 정점 11, 12와 여수해만 정점 16을 제외하고 모든 정점에서 선충류의 출현 비율이 약 90% 이상을 차지하였고, 출현분류군 또한 매우 제한적으로 출현하는 결과를 나타냈다. 특히 2010년 여름과 비교하여도 선충류의 출현 비율이 높은 증가를 나타냈고, 특히 광양만 서부 내만역 정점에서는 선충류 외에 다른 분류군의 출현비율이 매우 낮은 값을 나타냈다(Figs. 3, 4). 이러한 결과가 광양만의 여름철 수심이 얕은 만 내측 정점들에서 발생하는 낮은 저층 용존산소와 영향이 있을 것으로 예상됐지만 상관관계 분석결과 저층 수온 및 퇴적물내 유기물 함량과 유의한 상관관계가 나타났다(p<0.01, p<0.05). 이러한 결과는 중형저서동물 그룹 중 주요 우점분류군인 선충류와 저서성 요각류의 생태학적인 차이가 잘 반영된 결과로 판단된다. 일반적으로 저서성 요각류와 동문동물은 중형저서동물 그룹 중에서 유기오염, 빈산소 환경 등 환경변화에 민감한 분류군으로 알려져 있고(Raffaelli, 1987; Higgins and Fleeger, 1980), 선충류는 생태적으로 그룹 자체로써 환경의 변동에 내성이 높을 뿐 아니라, 일부 종들은 빈산소 환경을 보다 더 선호하는 특성을 갖고 있다(Heip, 1980; Raffaelli, 1987; Moore and bett, 1989; Coull and Chandler, 1992).
3.3 중형저서동물 출현 개체수
2010년의 계절별 평균 서식밀도는 겨울에 가장 낮은 서식밀도를 나타냈고, 봄에 447±92 ind.10 m-2가 출현하여 겨울에 비해 상대적으로 약 3배 높은 서식밀도를 나타냈다. 그리고 여름에 248±84 ind.10 m-2가 출현하여 소폭 감소하였고, 가을에 332±80 ind.10 m-2가 출현하여 소폭 증가하는 경향을 나타냈다(Table 2).
Table 2. Abundance of meiofauna from study area in 2010 (Unit: ind./10 m-2)
2011년의 계절별 평균 서식밀도는 2010년과 대조적으로 겨울에 전 계절 중 가장 높은 서식밀도를 나타냈고, 봄에 362± 121 ind.10 m-2가 출현하여 서식밀도가 겨울에 비해 상대적으로 약 2배 이상 감소하였다. 그리고 여름에 302±106 ind.10 m-2가 출현하였고, 가을에 289±84 ind.10 m-2가 출현하여 봄, 여름, 가을의 서식밀도는 큰 차이를 보이지 않았다(Table 3). 2010년 겨울에 전 계절 중 가장 낮은 평균 4±2개의 출현분류군수를 나타냈고, 2010년의 계절별 평균 출현분류군수는 겨울에 가장 낮은 4±2개 봄, 여름, 가을은 8±2개 출현분류군수를 유지하였다(Tables 2, 3). 2011년의 계절별 평균 출현분류군수는 2010년과 대조적으로 겨울에 가장 높은 9±2개 출현분류군수를 나타냈고, 봄에 8±2, 여름에 가장 낮은 6±2, 가을에 7±2개 분류군이 출현하였다(Table 3). 2010년과 2011년 전 계절에 출현한 중형저서동물의 분류군수는 총 21개 분류군이 출현하였으며, 이러한 분류군수는 김 등(2000)에 의해 다른 연안 해역에서 조사 된 20개 전후의 분류군이 출현한 결과와 비슷하다(김 등, 2000).
Table 3. Abundance of meiofauna from study area in 2011 (Unit: ind./10 m-2)
중형저서동물의 2010년 정점별 공간분포 특성을 보면 겨울은 21 ~ 591 ind.10 m-2의 범위를 나타냈고, 광양만 묘도 북측수로 정점 7에서 가장 낮은 21 ind./10 m-2를 주수로역 정점 13에서 가장 높은 591 ind.10 m-2를 나타냈다(Fig. 5). 2010년 전 계절 중 가장 낮은 평균 서식밀도를 나타냈으며, 상대적으로 광양만 서부 내만역 정점들 보다는 주수로역 정점들이 높은 서식밀도를 나타냈다. 봄은 168 ~ 997 ind.10 m-2의 범위를 나타내어 겨울에 비하여 상대적으로 서식밀도가 급증하였다. 만 내 쪽 정점 11에서 가장 낮은 168 ind.10 m-2를 주수로역 정점 15에서 가장 높은 997 ind.10 m-2를 나타냈다. 전 계절 중 가장 높은 평균 서식밀도를 나타냈다. 특히 묘도 서부 내만역 정점 1, 5, 7, 8, 9과 여수해만 정점 15, 16, 17, 20이 높은 서식밀도를 나타냈다. 봄철 서식밀도의 증가 요인을 파악하기 위해 본 연구에서 측정한 환경특성과 상관관계 분석결과 유의한 상관관계가 나타나지 않았다. 이러한 결과는 광양만의 봄철 서식밀도 증가가 다른 요인에 의해 영향을 받은 것으로 예상된다. 조 등(2013)에 의해 1987년부터 2010년까지 광양만에서 수행된 연구에 의하면 광양만은 봄철 chlorophyll a가 높은 값을 나타냈다. 중형저서동물은 퇴적물 내의 박테리아, chlorophyll a와 밀접한 관계가 있다고 알려져 있는데(Danovaro et al., 1999; Grove et al., 2006), 이러한 높은 chlorophyll a에 의한 저서생태계의 영향에 대해서 향후 고려되어야 할 환경요인으로 판단된다. 여름은 9 ~ 553 ind.10 m-2의 범위를 나타냈고, 주수로역 정점 10에서 가장 낮은 9 ind./10 m-2를 광양만 서부 내만역 정점 1에서 가장 높은 553 ind.10 m-2를 나타냈다. 여수해만 정점 17을 제외하고 봄에 비하여 상대적으로 정점별 서식밀도가 급감하여 나타났다. 가을은 84 ~ 591 ind.10 m-2의 범위를 나타냈고, 서부 내만역 정점 2에서 가장 낮은 84 ind.10 m-2를 묘도 남측수로 정점 5에서 가장 높은 591 ind.10 m-2를 나타냈다. 가을은 다른 계절과 비교하여 상대적으로 광양만 서부 내만역 정점들과 주수로역 정점들의 서식밀도가 큰 차이를 보이지 않았다(Fig. 5).
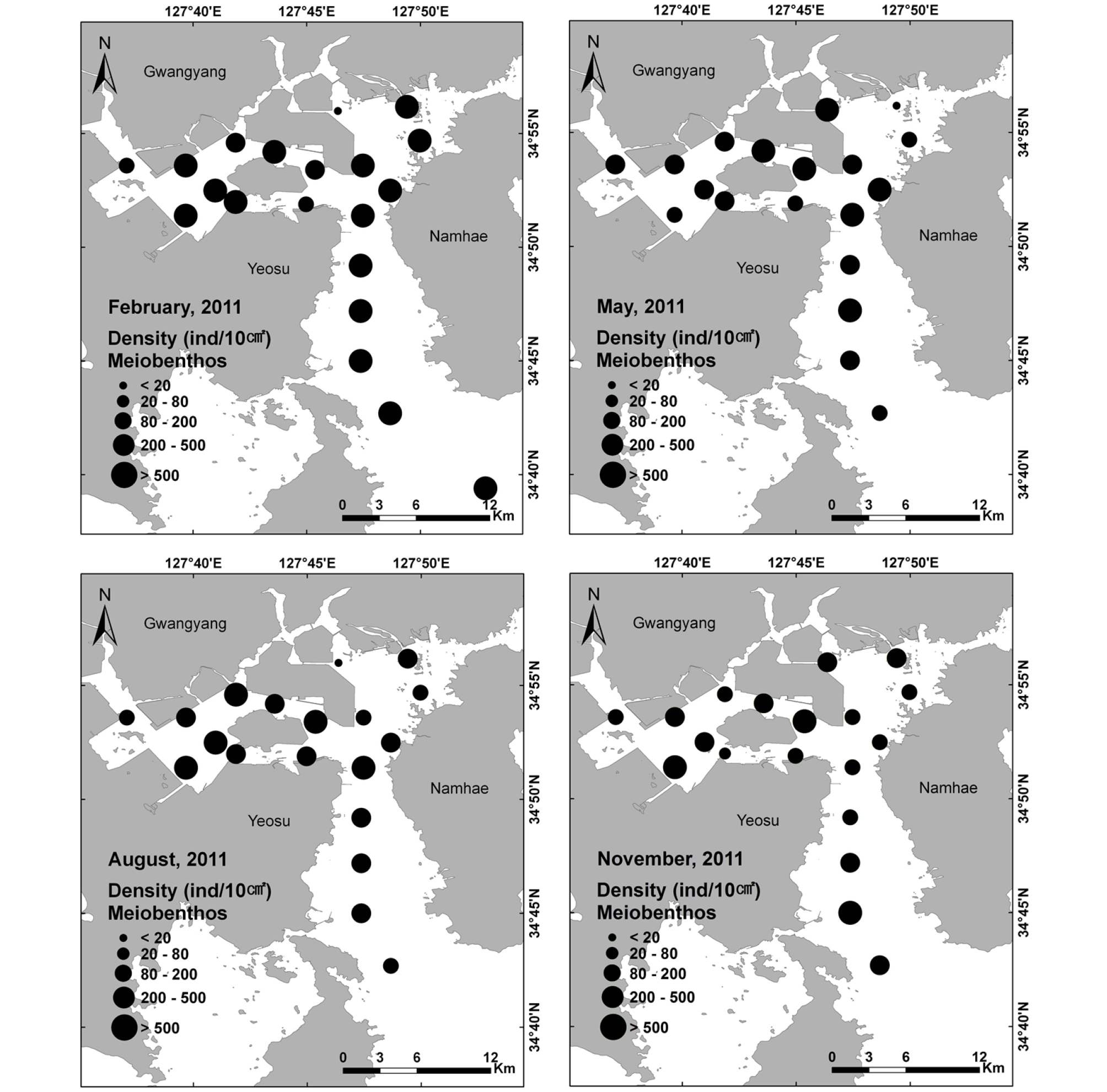
2011년 정점별 서식밀도의 공간분포 특성을 보면 겨울은 95 ~ 3109 ind.10 m-2의 범위를 나타냈고, 만 내 쪽 정점 9에서 가장 낮은 95 ind.10 m-2를 같은 만 내 쪽 정점 4에서 가장 높은 3109 ind.10 m-2를 나타냈다(Fig. 6). 2010년 겨울과 대조적으로 전 계절 중 가장 높은 평균 서식밀도를 나타냈다. 봄은 81 ~ 974 ind.10 m-2 범위를 나타냈고, 묘도 남측수로 끝단 정점 9에서 겨울과 같이 가장 낮은 81 ind./10 m-2를 묘도 북측수로 정점 7에서 가장 높은 974 ind.10 m-2를 나타냈다. 여름은 13 ~ 587 ind.10 m-2 범위를 나타냈고, 주수로역 정점 10에서 2011년 전 정점 중에서 가장 낮은 서식밀도를 나타냈다. 가을은 40 ~ 836 ind.10 m-2의 범위를 나타냈고, 묘도 서부 내만역 정점 5에서 40 ind.10 m-2를 정점 3에서 가장 높은 836 ind.10 m-2를 나타냈다. 특히 2010년과 비교하여 서식밀도가 겨울에 큰 폭으로 증가하였으며, 정점별로 상대적으로 개체수가 증가하는 경향을 나타냈다(Fig. 6).
일반적인 중형저서동물의 계절적인 서식밀도 분포 양상은 겨울에 낮은 온도 등으로 인하여 전체 서식밀도가 감소하는 경향이 나타나며, 여름에는 높은 서식밀도를 나타내는 경향이 있다(James and Mark, 2004). McIntyre (1969)에 의하면 일반적으로 천해계의 중형저서동물 서식밀도는 105 ~ 106 ind.10 m-2 이고, 빈 영양의 해역에서도 104 ~ 105 ind.10 m-2의 값을 나타낸 것과 비교하여도 낮은 서식밀도를 나타냈다. 본 연구에서는 이러한 일반적인 서식밀도의 계절적 변동 양상은 뚜렷하게 나타나지 않았으며, 환경요인과의 상관관계 분석 결과에서도 총 서식밀도는 겨울과 가을에 유의한 상관관계가(p<0.01, p<0.05) 나타났지만 봄과 여름에는 유의한 상관관계가 나타나지 않았다.
3.4 군집분석
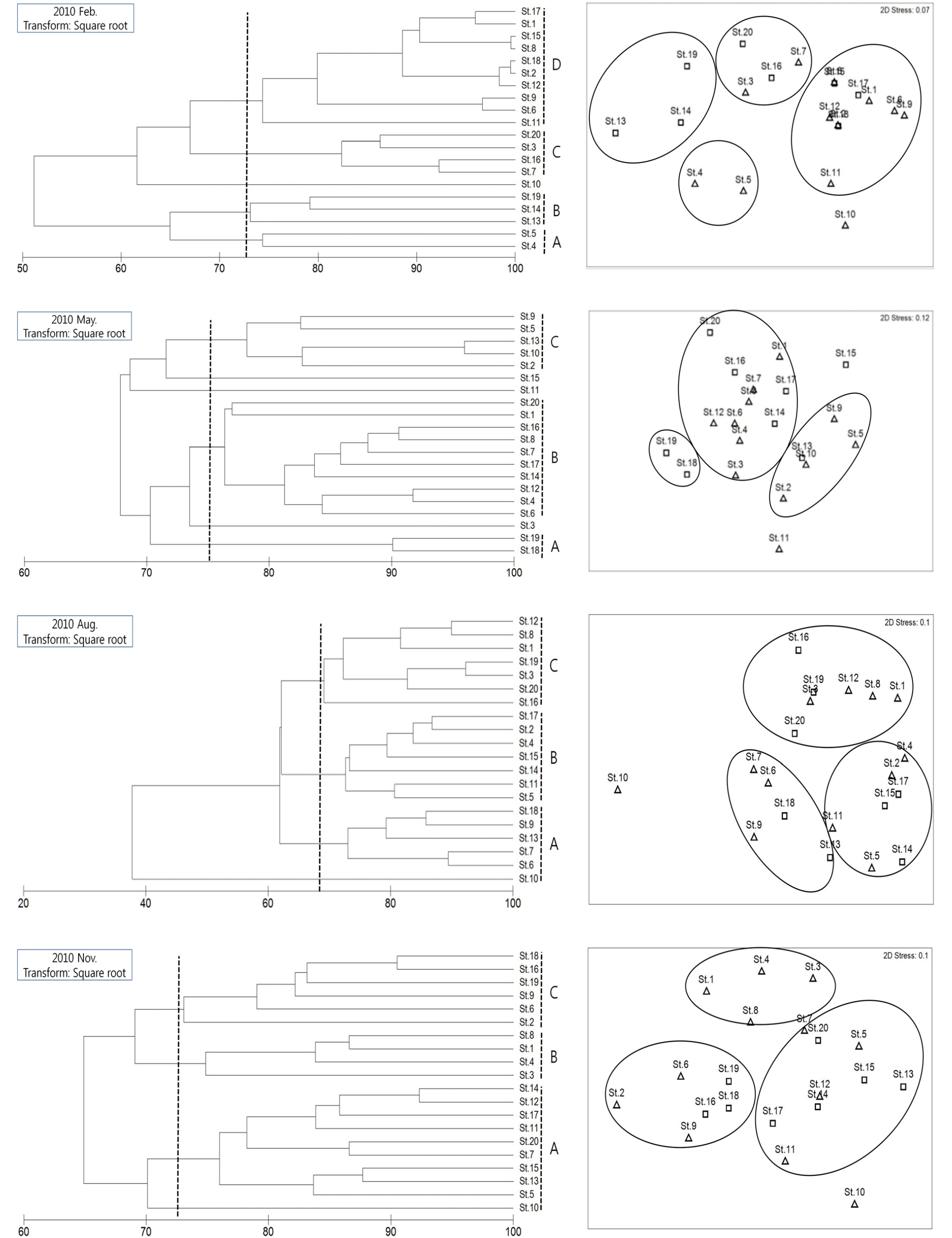
중형저서동물의 서식밀도에 따른 Bray-curtis 유사도 지수 자료를 사용하여 nMDS 배열법으로 군집 분석을 실시하였다. 분석 결과 2010년 겨울은 네 그룹으로 구분되어졌고(Fig. 7), 네 그룹의 구분에 영향을 준 중형저서동물 분류군의 SIMPER 분석 결과를 보면 모든 그룹에서 선충류의 기여도가 가장 높게 나타났다(Table 4). 그리고 저서성 요각류의 기여도가 높은 순으로 나타났다. 선충류와 저서성 요각류를 제외한 다른 분류군은 갑각류 유생과 다모류로 나타났다. 구분된 네 그룹 중 A 그룹은 분류군 다양도 지수가 가장 높은 1.32를 나타냈고, 선충류의 기여도가 90% 이상인 C, D 그룹은 각각 0.222, 0.203으로 낮은 값을 나타냈다. 이와 같은 결과는 남해안 가막만에서(김 등, 2000) 연구된 분류군 다양도 지수 값이 0.6 ∼ 1.8로 나타난 것과 비교하여도 낮은 값을 나타냈다. 봄은 세 그룹으로 구분되어졌고, 구분된 세 그룹 또한 선충류의 기여도가 가장 높았다. 선충류 외에도 저서성 요각류, 유공충, 다모류, 갑각류 유생, 이매패류의 분류군 기여도가 봄과 비교하여 높게 나타났다. 분류군 다양도 값은 1.133 ∼ 1.704의 범위로 나타났고, 저서성 요각류와 갑각류 유생의 기여도가 높게 나타난 그룹 C에서 가장 높은 분류군 다양도 값을 나타냈다. 여름도 세 그룹으로 구분되어졌고, 구분 된 세 그룹 중 C 그룹에서 선충류의 기여도가 80% 로 가장 높게 나타났다. A 그룹과 B 그룹은 분류군 기여도가 유사한 경향을 나타냈고, 분류군 다양도 값 또한 각각 1.467, 1.608으로 큰 차이를 보이지 않았다. 그리고 여름은 이매패류의 분류군 기여도가 다른 계절에 비해 높게 나타나는 결과를 나타냈다. 가을 또한 세 그룹으로 구분되어졌고, 특히 A 그룹은 앞선 계절에서 기여도가 나타나지 않은 동문동물이 그룹을 구분하는데 영향을 주는 결과를 나타냈다. 하지만 B 그룹은 선충류의 기여도가 80% 이상을 차지한 결과 분류군 다양도 값이 매우 낮은 0.911을 나타냈다. 계절별 분류군 다양도 값을 비교해보면 겨울에 가장 낮고 봄과 여름에 증가하다 가을에 소폭 감소하는 경향을 나타냈다.
Table 4. Summary of SIMPER analysis, comparing the major aspects of the meiofauna communities across the three to four groups from study area, 2010
Table 5. Summary of SIMPER analysis, comparing the major aspects of the meiofauna communities across the three to four groups from study area, 2011
Table 6. Spearman rank correlation coefficients between environmental parameters and biological variables (*, P<0.05; **, P<0.01; ns, not significant; (B) is bottom)
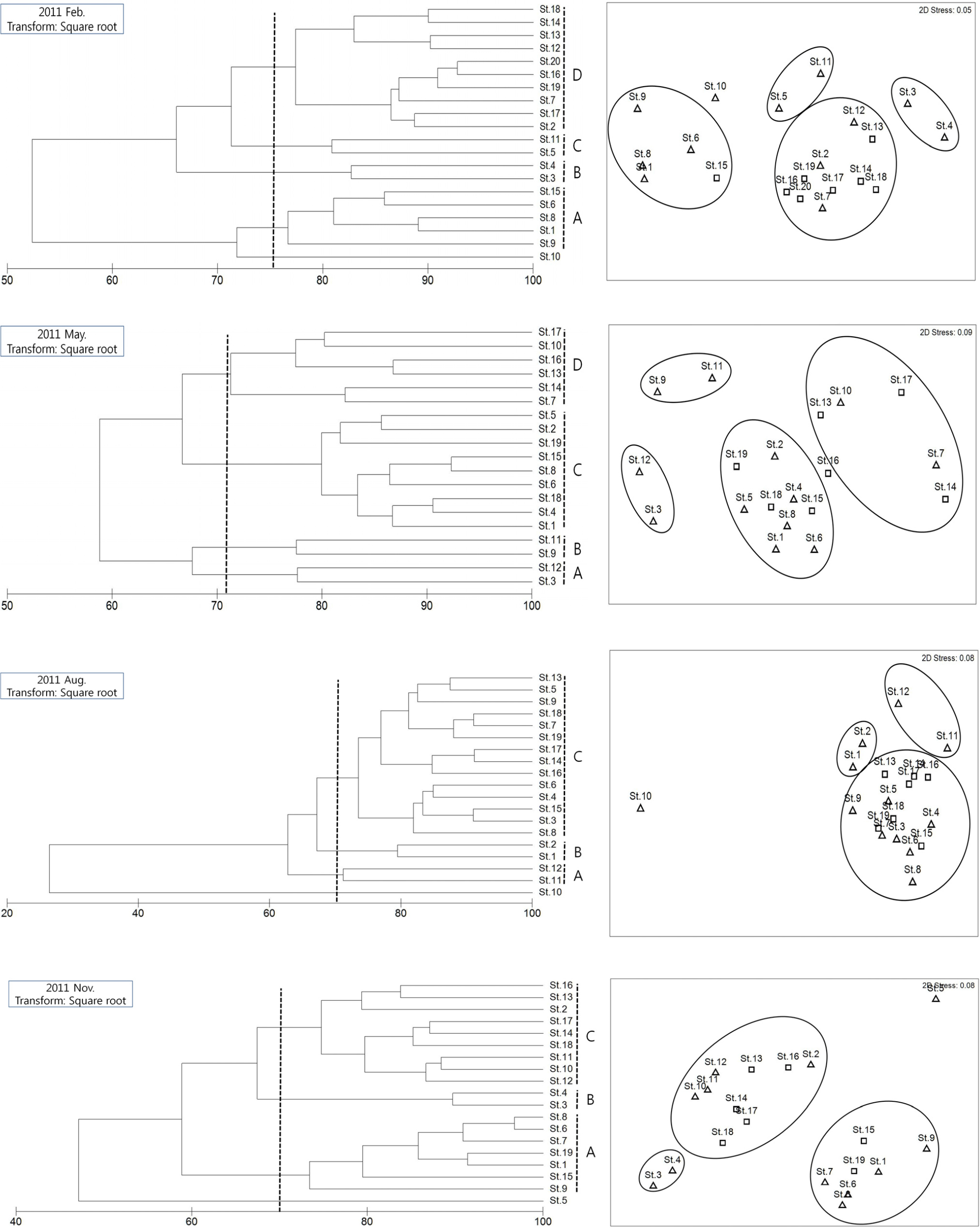
2011년은 겨울과 봄은 네 그룹으로 구분되어졌고, 가을과 겨울은 세 그룹으로 구분되어졌다(Fig. 8). 특히 겨울과 봄은 다양한 분류군의 기여도가 높게 나타났고, 분류군 다양도 지수 또한 높은 결과를 나타냈다. 겨울의 경우 A 그룹을 제외한 세 그룹에서 선충류의 기여도가 약 39 ∼ 47% 의 나타냈고, 저서성 요각류, 갑각류 유생, 동문동물 등 다른 계절들과 비교하여 높은 기여도를 나타냈다(Table 5). 그리고 2010년 겨울과 비교하여도 다양한 분류군의 출현으로 인한 높은 다양도 지수를 나타냈고, 그룹을 구분 짓는 기여도를 나타냈다. 봄은 겨울과 분류군 다양도 지수, 각 분류군의 기여도가 큰 차이를 보이지 않은 것으로 나타났다. 세 그룹으로 구분 된 여름과 가을은 전체적으로 선충류의 기여도가 앞선 겨울과 봄보다 높은 값을 나타냈고, 특히 여름의 A 그룹은 다모류가 그룹을 구분하는 중요한 분류군으로 나타났다. 가을은 A 그룹에서 선충류의 기여도가 약 90% 이상을 차지하는 높은 결과를 나타냈고, 분류군 다양도 값 또한 전 계절 중 가장 낮은 0.612를 나타냈다. 계절별 분류군 다양도 값을 비교해보면 2010년과는 상반된 결과가 나타났는데 겨울에 가장 높고 봄에서 여름으로 계절이 변화됨에 따라 감소되어 가을에 소폭 증가하는 경향이 나타났다. 광양만의 중형저서동물 군집 특성이 일반적인 계절 변동 양상과 다르게 뚜렷한 패턴이 나타나지 않는 것은 광양만의 저서생태계가 자연적인 환경 변화에 영향을 받기보다는, 육지로부터 유입되는 여러 유입물질과 인공적으로 가해지는 환경적 변화요소가 불규칙적인 변화를 가져오는 원인으로 생각된다. 즉, 광양만의 중형저서동물 군집 조성을 변화시키는 요인으로 각 우점 분류군별로 다양한 환경 요인에 의해 영향을 받는 것으로 판단된다. 우점 분류군인 저서성 요각류와 유공충류는 여름철 퇴적물내 유기물 함량 (p<0.01, p<0.05), 겨울철 퇴적물의 평균입도와 음의 상관관계를 나타냈다 (p<0.01). 그러나 서식밀도의 경우 계절적 변화 경향이 뚜렷하지 않은 것은 최우점 분류군인 선충류의 높은 서식밀도 유지와 밀접한 영향이 있는 것으로 판단된다. 선충류의 경우 겨울철 저층 수온 및 퇴적물 입도를 제외하고 다른 환경요인과 상관관계가 나타나지 않았는데 이러한 결과는 환경이 변화하여도 선충류의 서식밀도에는 큰 영향을 주지 않는 것으로 판단된다(Table 6). 특히 선충류 중에는 깨끗한 환경보다 오염된 환경을 더 선호하는 그룹이 있는데(Heip, 1980) 이러한 특정 종의 기회적 출현으로 인한 서식밀도의 변화가 나타난 것으로 예상되며, 중형저서동물의 서식밀도에 있어 계절적 변동은 모래 퇴적물 보다는 펄로 구성된 퇴적물에서 더욱 변화가 크게 나타나는 경향이 있는데(Bruce, 1985), 광양만의 경우 대부분의 정점에서 Silt와 Clay 함량이 90% 이상을 나타내어 이러한 서식밀도의 불규칙적인 변화가 나타난 것으로 판단된다.
4. 결 론
광양만에서 계절별 중형저서동물의 분포를 파악한 결과 계절별 서식밀도와 지역별 분류군의 변동은 나타났지만 일반적인 계절 변동 양상과 다르게 뚜렷한 경향이 나타나지 않았다. 이러한 결과는 광양만의 저서생태계가 자연적인 환경 변화에 영향을 받기보다는 육지로부터 유입되는 여러 유입물질, 인공적으로 가해지는 준설 등과 같은 교란에 의해 불규칙적인 변화가 나타나고 있음을 시사한다. 특히 선충류는 광양만의 중형저서동물 군집을 구분 짓는데 높은 기여도를 나타냈으며, 계절변동이나 다른 환경요인에 크게 영향을 받지 않고 서식밀도를 꾸준히 유지하는 것으로 나타났다. 이러한 선충류의 서식밀도 유지는 환경 교란 등과 같은 환경변화에 의해 특정 종의 기회적 출현에 기인한 것으로 판단된다. 최 등(2003)에 의해 광양만에서 연구된 대형저서동물의 하계 공간분포양상에서도 우점분류군은 다모류로 과거와 비교하여 변화되지 않았으며, 서식밀도는 조사해역별로 차이가 나타났다. 즉, 광양만의 저서생태계는 대형저서동물과 중형저서동물 모두 우점분류군의 변화는 나타나지 않았으며, 특정 우점분류군인 다모류와 선충류에 의해 군집이 구분되는 것으로 나타났다. 다만 대형저서동물 공간분포 연구는 우점분류군인 다모류의 종조성 분석을 통해 저서생태계를 파악하였지만 본 연구는 중형저서동물의 우점분류군인 선충류 종조성 분석의 한계로 인해 대형저서동물과 중형저서동물의 군집특성 비교를 통한 저서생태계 분석에는 다소 어려움이 있다. 향후 중형저서동물 중 우점분류군인 선충류의 속(Genus) 또는 종(Species) 수준의 종조성 분포를 파악한다면 교란된 환경에서 기회적으로 출현하는 특정 기회종의 파악, 섭식 유형 분석 등을 통해 광양만의 저서생태계를 좀 더 면밀히 분석할 수 있을 것으로 생각된다.